NTRK基因融合与高达1% 的实体瘤和0.2%的非小细胞肺癌发病相关。拉罗替尼是所有三种 TRK 蛋白的高选择性小分子抑制剂,对多种实体瘤的缓解率高达75%。拉罗替尼的原发耐药机制尚不清楚。今天分析的病例是一例吸烟史极少的75岁男性肺鳞癌患者,携带NTRK基因融合,对拉罗替尼原发性耐药。NTRK1融合可能是导致拉罗替尼原发性耐药的原因。
拉罗替尼被美国FDA批准用于NTRK基因(即原肌球蛋白受体激酶)融合的酪氨酸激酶抑制剂,拉罗替尼在NTRK融合的非小细胞肺癌中显示出持久反应。临床治疗中很少见到拉罗替尼的原发性耐药病例。这里介绍一例携带NTRK1融合的转移性肺鳞癌患者。该患者在拉罗替尼一线治疗期间经历了原发性进展。
一名 75 岁男性,患有高血压、高脂血症,有前列腺癌病史,曾接受前列腺切除术,出现右侧胸痛和劳力呼吸困难。患者极少吸烟,并在就诊前 50 年已戒烟。就诊时,观察到患有锁骨上淋巴结肿大,提示转诊进行颈部超声检查,证实右侧锁骨上淋巴结肿大。随后的影像学检查显示右锁骨上淋巴结肿大(图1_A),右上叶有一个 4.3 厘米的毛刺肿块(图1_B))、广泛的双侧胸部淋巴结肿大、右侧胸膜增厚、双侧肺部实性结节和溶解性胸骨病变。脑磁共振成像未显示颅内转移。
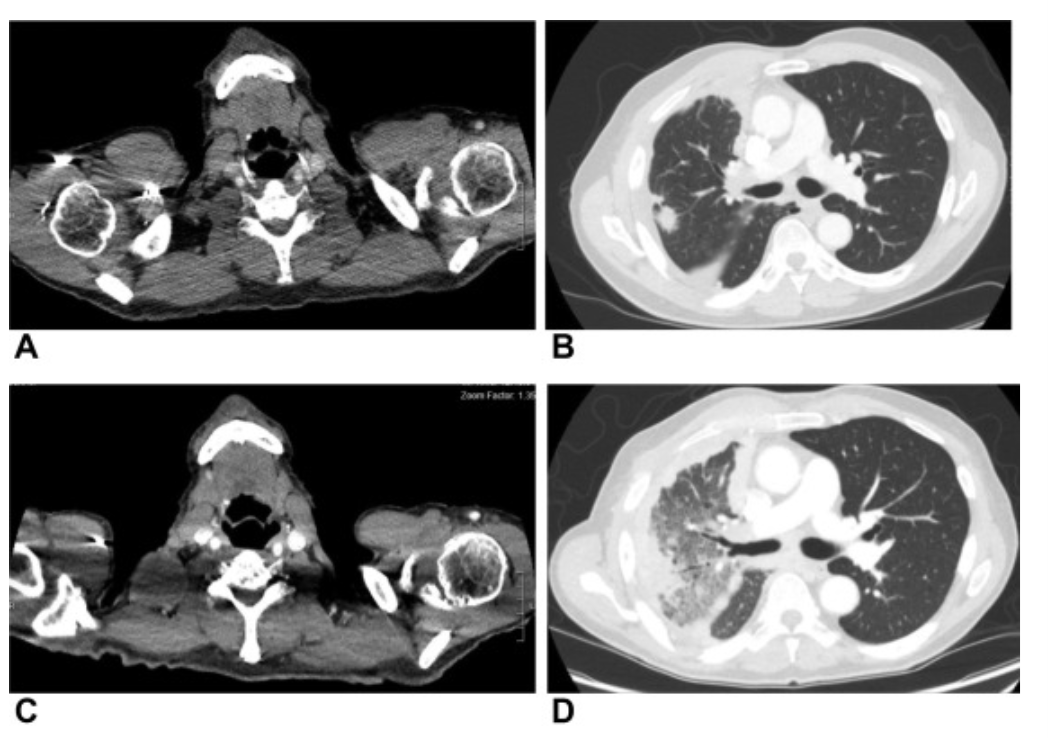
图1 ( A ) 颈部CT 显示右侧锁骨上淋巴结肿大,( B ) 右上叶肿块。( C ) CT 显示在开始拉罗替尼治疗后右侧锁骨上淋巴结肿大增大。( D ) CT 显示右上叶肿块增大,拉罗替尼治疗后结节状小叶间隔增厚。
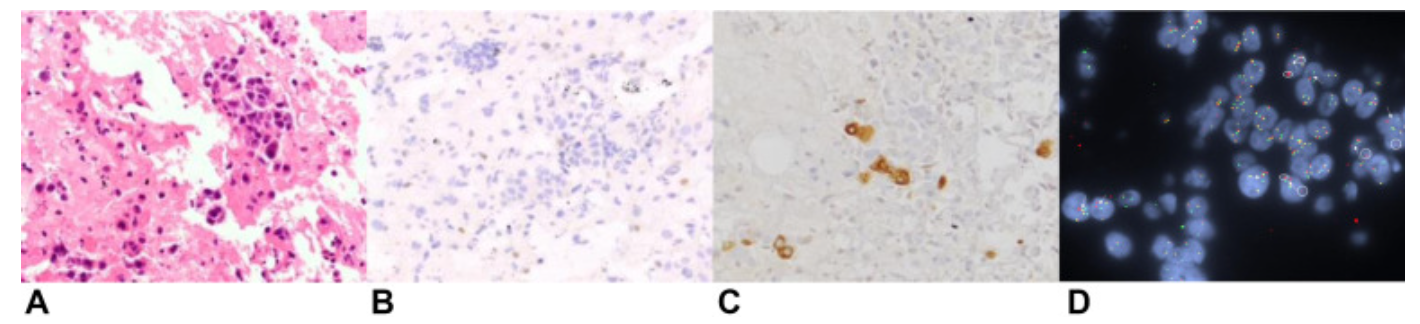
患者通过支气管镜和支气管内超声对纵隔淋巴结取样。右侧气管旁和隆突下淋巴结显示为非小细胞癌(图2_A)。通过免疫组织化学 (IHC) 检测,细胞 p40 呈弥漫性阳性,TTF-1 和 Napsin A 呈阴性,与非小细胞癌一致,趋于鳞状细胞癌。IHC 还显示大多数肿瘤细胞中 BRG1 核表达缺失(图2_B)。DNA 和 RNA 鉴定显示出F11R基因的外显子 6 与NTRK1的外显子 10 并置融合,此外还发现了KEAP1 G364C、STK11改变、PIK3R1 N630T 和SMARCA4改变。
根据检测结果,患者开始接受拉罗替尼100 mg 每天两次作为转移性肺鳞癌的一线治疗。治疗一个月后,患者出现呼吸困难、胸痛、体重减轻以及右侧锁骨上淋巴结肿大增加。影像学检查证实了疾病的原发性进展,右侧锁骨上区(图1_C)、肺部(图1_D)、胸膜和胸骨,包括增加的淋巴结肿大。患者随后从拉罗替尼换为卡铂和紫杉醇。两个周期后,影像学显示右上叶肿块减少、右胸膜转移、小叶间隔增厚和淋巴结肿大等症状均有好转。然而,在第三个周期的卡铂和紫杉醇治疗后,影像学显示疾病进展,涉及右侧锁骨上淋巴结、胸膜、胸骨和新的肝包膜旁结节。患者随后转用纳武单抗。
拉罗替尼的临床数据显示:在携带NTRK基因融合的非小细胞肺癌患者中客观缓解率为73%,中位无进展生存期为 35.4 个月。对拉罗替尼的原发耐药性很少见。事实上,在第一阶段的临床试验中,只有 6 名患者 (11%) 出现原发性进展。在这 6 名患者中,一名患者之前曾接受过 TRK 抑制剂治疗,并且存在NTRK3 G623R 突变,该突变会干扰拉罗替尼的结合。其余5名患者,肿瘤组织的中央 IHC 检测未证实TRK表达的存在,引发了假阳性NTRK融合。
鉴于非小细胞肺癌中NTRK融合的罕见性、对拉罗替尼的原发耐药的罕见发生以及对导致 拉罗替尼原发耐药因素的了解有限,这里总结了该患者独特的治疗过程。此例患者有几个显著特征,包括NTRK融合的亚克隆性、鳞状分化以及与侵袭性肿瘤生物学相关的共同改变,包括SMARCA4、KEAP1和STK11的突变。在治疗具有EGFR T790M 突变的转移性非小细胞肺癌时,临床已经探索了亚克隆性问题,其中克隆性与奥希替尼反应的持久性相关。
此病例描述了可能导致拉罗替尼原发性耐药的肿瘤特征, NTRK融合的克隆性。对于具有不良分子和组织学特征的NTRK重排 NSCLC患者,临床上建议优先考虑不区分基因型的治疗策略,而不是 TRK 抑制剂作为一线治疗。