免疫抑制剂会增加感染的易感性,可能促进淋巴瘤和其他肿瘤的发生。只有对免疫抑制治疗和对接受器官移植的患者有经验的专科医师才可以使用本品,患者应在配备相应的医疗设备和实验室人员及可支持的医疗条件下接受本品的治疗。负责病人长期随访的医师应掌握病人的全面信息以便对患者进行必要的随访。 由于本品具有致突变和致畸效应,具有生育能力的女性患者在开始使用本品进行治疗之前,须证实妊娠试验结果为阴性,并在开始使用本品前至停用本品后6周期间采用避孕措施。在妊娠期间使用本品可能增加流产、先天性畸形等风险。
【成份】
化学名称:(E)-6-(4-羟基-6-甲氧基-7-甲基-3-氧代-1,3-二氢异苯并呋喃-5-基)-4-甲基-4-己烯酸 2-(吗啉-4-基)乙酯
化学结构式:
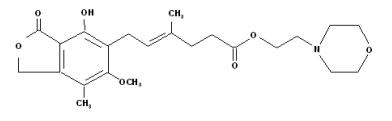
分子式:C23H31NO7
分子量:433.49
【规格】
0.5g
【适应症】
本品与皮质类固醇以及环孢素或他克莫司同时应用,适用于治疗:
• 接受同种异体肾脏移植的患者中预防器官的排斥反应。
• 接受同种异体肝脏移植的患者中预防器官的排斥反应。
本品适用于 III-V 型成人狼疮性肾炎患者的诱导期治疗和维持期治疗。
【用法用量】
已经证明吗替麦考酚酯具有致畸性作用,因此禁止压碎吗替麦考酚酯片。如果发生接触,用肥皂和清水彻底清洗,并用清水冲洗眼睛。
对于和本品同时使用的皮质类固醇及环孢素或他克莫司,请参阅相应的完整处方信息。
肾脏移植:
成人:对肾移植受者,推荐口服剂量为每次 1 g,每日 2 次(日剂量为 2 g)。虽然在临床试验中用过每次 1.5 g,每日 2 次(日剂量 3 g),且是安全和有效的,但在肾脏移植中并没有效果上的优势。每天接受 2 g 本品的患者在总的安全性上比接受 3 g 的患者要好。
肝脏移植:
成人肝脏移植受者推荐口服剂量为每次 0.5-1 g,每日 2 次(日剂量 1-2 g)。
在肾脏或肝脏移植后应尽早开始口服本品治疗。食物对麦考酚酸(MPA)AUC 无影响,但使 MPACmax下降 40%。因此推荐本品空腹服用。但是对稳定的肾脏移植受者,如果需要本品可以和食物同服。
狼疮性肾炎患者:
诱导期治疗
成人推荐剂量为每日 1.5-2 g,分两次口服给药。
本品通常应与皮质类固醇联合使用。
维持期治疗
成人推荐剂量为每日 0.5-1.5 g,分两次口服给药。
剂量调整:
肝损害患者
不建议对伴有严重肝实质病变的肾脏移植受者调整剂量。但是,其他原因的肝脏疾病是否需要做剂量调整不清楚(见【药理毒理】和【药代动力学】)。
对伴有严重肝实质病变的狼疮性肾炎患者尚无数据。
肾损害患者
对于有重度慢性肾脏损害(肾小球滤过率小于 25 mL/min/1.73m2)的肾移植受者,在渡过了术后早期后,或者对急性或难治性排斥反应进行治疗后,应避免使用大于每次 1 g,每日 2 次的剂量。肾移植后移植物功能延迟恢复的患者,无需调整剂量,但这些患者需要严密观察。(见【药代动力学】)。
未获得重度肾损害的肝脏移植受者的数据。如果潜在的益处大于潜在的危害,重度慢性肾脏损害的患者同时接受肝脏移植后可以使用本品。
目前对于 GFR<30 mL/min 的狼疮性肾炎患者的数据尚不充分,如需使用本品,建议进行治疗药物浓度监测。
出现中性粒细胞减少症的患者
如果出现中性粒细胞减少(绝对中性粒细胞计数 < 1.3 × 103/μL),本品应暂停或减量,进行相应的诊断性检查和适当的治疗(见【注意事项】和【不良反应】)。
老年患者
合适的肾脏移植受者推荐剂量为每次 1 g,每日 2 次,肝脏移植受者为每次 0.5-1 g,每日 2 次(见【老年用药】)。狼疮肾炎老年患者使用本品的数据尚不充分,暂无推荐剂量。
【禁忌】
本品禁用于已知对于吗替麦考酚酯、麦考酚酸或本品中任何成份过敏者。
本品禁用于孕妇。
本品禁用于未使用高效避孕方法的育龄期妇女。
本品禁用于哺乳期妇女。
【注意事项】
注意:本品用于治疗狼疮性肾炎时,应由具有狼疮性肾炎治疗经验的专科医生进行给药。
在包装上标明的有效期后不能再服用。
药品请存放于小孩接触不到处。
淋巴瘤及其他肿瘤:
接受免疫抑制剂治疗的患者,包括联合用药,接受本品作为部分免疫抑制治疗,发生淋巴瘤及其它恶性肿瘤的危险性增加,尤其是皮肤(见【不良反应】)。危险性与免疫抑制的强度和疗程有关,而与特定的免疫抑制剂无关。
由于患者发生皮肤癌的危险性增加,应通过穿防护衣或含高防护因子的防晒霜来减少暴露于阳光和紫外线下。
感染:
免疫系统的过度抑制可增加对感染的易感性,包括条件机会性感染,致死感染和败血症。这种感染包括潜伏病毒的再激活,如乙肝或丙肝病毒的再激活,或多瘤病毒引起的感染。已有使用免疫抑制剂治疗的肝炎病毒携带者因乙肝或丙肝病毒再激活引发肝炎的病例报道。
使用本品治疗的患者中,有发生与 JC 病毒相关的进行性多灶性白质脑病(PML)病例中报道,且部分病例为致死性病例,PML 通常表现为轻偏瘫、冷淡、意识模糊、认知障碍和共济失调。报告的病例一般具有 PML 的危险因素,包括免疫抑制剂疗法和免疫功能缺损。对于免疫抑制患者,医生应考虑对报告有神经症状的患者采取 PML 鉴别诊断,还应请神经病学家给予专科专家意见。
在肾移植后使用本品治疗的患者中有 BK 病毒相关性肾病的报道,这种感染可能造成严重的后果,有时候可能导致肾移植失败。对病人进行监测有助于发现其罹患 BK 病毒相关性肾病的风险。由于 MPA 对 B 淋巴细胞和 T 淋巴细胞的增殖具有抑制作用,COVID-19 的严重度可能会增加。对于有确诊 BK 病毒相关性肾病迹象或发生具有临床意义的 COVID-19 感染的患者应考虑降低 MPA 剂量或终止给药。
血液及免疫系统:
在每日接受 3 g 本品治疗的肾移植受者和肝移植受者中,分别有 2.0%、3.6% 患者出现严重中性粒细胞减少症【中性粒细胞计数(ANC)<0.5 × 103/µL】。患者在接受本品治疗的第一个月内,应每周完成一次全血细胞计数检验;在治疗的第二个月和第三个月内,应每月完成两次检验;然后至一年时,应每月完成一次检验。应特别监测中性粒细胞减少症的出现情况(见【注意事项】:实验室检验)。中性粒细胞减少症的出现可能与本品有关,也可能与合用药物、病毒感染或综合原因等有关。如果出现中性粒细胞减少症(ANC<1.3 × 103/µL),应中断本品给药,或降低剂量并密切观察(见【用法用量】)。观察到预防肾移植或肝移植排异反应患者最常出现中性粒细胞减少症的时间是移植后 31-180 天。
在接受本品联合其他免疫抑制剂治疗的患者中,有报道发生单纯红细胞再生障碍(PRCA)。本品导致 PRCA 的机理尚不清楚;其他免疫抑制剂作为联合应用药物在免疫抑制治疗中引起 PRCA 的相关作用也尚不清楚。在一些病例中,随着本品剂量的减小或中止,发现 PRCA 是可逆的。然而,对于移植受者,降低免疫抑制作用可能使移植物遭受排斥风险增大。
应告知接受本品治疗的患者,在出现任何感染症状、意外瘀肿、出血、其他骨髓抑制或胃肠道症状时应立即汇报。
献血:
患者在治疗期间以及本品停药后至少 6 周内不应献血。
疫苗接种:
患者应被告知在本品治疗中进行疫苗接种可能效果欠佳。而且应当避免使用减毒活疫苗(见【药物相互作用】)。流感疫苗接种是有益的。流感疫苗接种时,处方者应当参考国家指南。
消化系统:
本品同消化系统不良反应的发生率增高有关,包括罕见的胃肠道溃疡、出血、穿孔,所以本品应慎用于有活动性消化系统疾病的患者。
理论上讲,因为本品是次黄嘌呤单核苷酸脱氢酶(IMPDH)抑制剂,应避免用于有罕见的次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HGPRT)遗传缺陷的患者,如莱-尼综合征和 Kelley Seegmiller 综合征。
相互作用:
含有本品的联合免疫抑制方案转换时需谨慎,因为部分药物可以影响 MPA 肝肠循环,例如将环孢素转换为他克莫司、西罗莫司或贝拉西普,则可以避免干扰 MPA 的肝肠循环;或者反之,则可能导致 MPA 暴露的变化(见【药物相互作用】)。
当转换联合治疗时(例如,从环孢素转换为他克莫司,或反之亦然),或者为了确保高免疫风险患者(例如,排斥风险,抗生素治疗,新增或移除相互作用药物)获得充分的免疫抑制时,可能需要对 MPA 进行治疗药物监测。
当本品与干扰 MPA 肝肠循环的其他类型药物(如消胆胺、司维拉姆、抗生素)联合使用时应谨慎,因为这些药物可能会降低本品的血浆浓度和疗效(见【药物相互作用】)。应在服用本品 2 小时后应用司维拉姆和其他非钙性磷酸盐结合剂,从而将其对 MPA 吸收的影响降至最低。
不推荐本品和硫唑嘌呤联合使用,因为两者都可能引起骨髓抑制,尚未对此联合给药进行临床研究。
特殊人群用药:
老年患者:
老年患者发生某些感染(包括巨细胞病毒组织侵袭性疾病),可能的胃肠道出血和肺水肿等不良事件的危险性高于年轻患者(见【不良反应】)。
孕妇和哺乳期妇女:本品禁用于孕妇和哺乳期妇女(见【孕妇及哺乳期妇女用药】)。
捐精
男性患者在治疗期间以及停用本品后 90 天内不得捐精。
药物滥用和依赖性:
无可用数据表明本品存在药物滥用和依赖性的可能性。
对驾驶和机器操作能力的影响:
本品可对驾驶和机器操作能力产生中度影响。
如果患者在接受本品治疗期间出现嗜睡、意识模糊、头晕、震颤或低血压等药物不良反应,应建议患者在驾驶或操作机器时慎用本品(见【不良反应】)。
具有生育能力的女性和男性:
生育力
本品禁止用于未使用高效避孕方法的育龄期妇女(见【禁忌】)。接受吗替麦考酚酯经口给药的雌性大鼠的第一代子代出现畸形(包括无眼、无颌和脑积水),但未出现母体毒性。未观察到对接受吗替麦考酚酯给药的雄性大鼠的生育力产生影响。
妊娠试验
具有生育能力的女性患者在开始使用本品进行治疗之前,必须有一次血清或尿液妊娠试验检测阴性结果,且灵敏度至少为 25mIU/mL。第二次检测应在首次检测后 8-10 天。患者在常规随访过程中,应重复进行妊娠试验检测。医生应就所有妊娠试验结果与患者进行讨论。患者应充分知悉,怀孕后需立即咨询医生。
避孕
•女性
本品禁止用于未使用高效避孕方法的育龄期妇女(见【禁忌】)。
具有生育能力的女性患者在开始使用本品进行治疗前,必须充分知悉本品会增加妊娠丢失和先天性畸形的风险,必须向医生咨询关于避孕和怀孕的建议。建议有生育能力的女性患者在开始使用本品进行治疗之前,治疗期间及治疗终止后 6 周内,应同时采用两种可靠的避孕措施,其中至少包含一种高效方法,或是选择禁欲作为避孕措施。这也包括有不育症病史的患者,已行子宫切除术的患者无需避孕。
•男性
目前关于父亲暴露于本品的临床数据有限。这些数据未提示父亲暴露于麦考酚酯后畸形或流产的风险增加。
非临床数据表明,通过精液转移至可能妊娠伴侣的麦考酚酯剂量是动物中无致畸作用浓度的 1/30,是动物中最低致畸浓度的 1/200。因此,认为通过精液导致损害的风险可忽略不计。但是,在暴露量大约为人体治疗暴露量的 2.5 倍的动物研究中,观察到遗传毒性效应。因此,不能完全排除对精子细胞产生遗传毒性效应的风险。
因数据不足,无法排除父亲治疗期间或治疗之后对受孕胎儿产生伤害的风险,建议采取以下预防措施:
建议性活跃的男性患者在治疗期间及治疗终止后至少 90 天内使用避孕套进行避孕。避孕套既适用于具有生殖能力的男性患者,也适用于输精管结扎术后的男性患者,因为输精管结扎术后的男性患者也可能存在致孕的相关风险。此外,建议男性患者的女性伴侣在其治疗期间及最后一剂本品给药后至少 90 天内采取高效的避孕方法。
患者信息:
•为患者出示完整给药说明,同时告知患者淋巴增生性疾病和某些其他恶性肿瘤的风险可能增加。
•告知患者,在接受本品治疗期间,需要患者反复接受实验室检验。
•告知育龄妇女,当在怀孕期间使用本品时,可能在前 3 个月内增加流产风险,还增加出生缺陷风险,他们必须采取有效避孕措施。
•与育龄女性患者商讨怀孕计划。
♦在开始接受本品前 4 周内,育龄妇女必须采取高效避孕措施(同时采取两种措施),当本品停止治疗后 6 周内,还必须继续采取避孕措施(见【孕妇及哺乳期妇女用药】)。
♦计划怀孕患者不应接受本品治疗,除非采用其他免疫抑制剂不能成功治疗。
实验室检验:
在治疗的第一个月,应每周完成一次全血细胞计数,在治疗的第二个月和第三个月内,应每月完成两次检验,然后至一年时每月完成一次检验。
【药理作用】
吗替麦考酚酯(简称 MMF)是麦考酚酸(MPA)的 2-乙基酯类衍生物。MPA 是高效、选择性、非竞争性、可逆性的次黄嘌呤单核苷酸脱氢酶(IMPDH)抑制剂,可抑制鸟嘌呤核苷酸的经典合成途径,抑制有丝分裂原和同种特异性刺激物引起的 T 和 B 淋巴细胞增殖,还可抑制 B 淋巴细胞产生抗体,抑制淋巴细胞和单核细胞糖蛋白的糖基化,因此可抑制白细胞进入炎症和移植物排斥反应的部位。已经确定的两种 IMPDH 异构酶,即大多数已知细胞(包括人静息淋巴细胞)中存在的异构体 I,以及高度且主要表达于人活化 B 和 T 淋巴细胞中的异构体 II。MPA 对异构体 II 抑制的敏感性几乎是异构体 I 的五倍。吗替麦考酚酯不能抑制外周血单核细胞活化的早期反应,如白介素-1 和白介素-2 的产生等,但可以抑制这些早期反应所导致的 DNA 合成和增殖反应。
MPA 除了抑制 IMPDH,进而导致淋巴细胞减少外,还可影响淋巴细胞代谢程序化的细胞检查点。关于人 CD4 + T 细胞的研究显示,MPA 可以将淋巴细胞的转录活性从增殖状态转为与代谢和存活相关的分解代谢过程,从而使 T 细胞处于免疫无能状态,进一步导致细胞对其特异性抗原无应答。
【药代动力学】
口服或静脉给药后,吗替麦考酚酯迅速并完全代谢为活性代谢产物 MPA。药物口服吸收迅速和基本完全吸收。MPA 代谢为为酚化葡萄糖醛麦考酚酸(MPAG)的形式,后者无药理活性。原药吗替麦考酚酯在静脉注射的过程中在身体中可以检测到,注射停止或口服后很短时间(大约 5 分钟)吗替麦考酚酯的浓度低于可定量的下限(0.4 μg/mL)。
吸收:在 12 例健康志愿者中口服本品的平均绝对生物利用度相当于静注的 94%(根据 MPA 的 AUC)。在肾移植受者中多次给药至每天 3 g 时,MPA 的血浆浓度时间曲线下面积(AUC)表现为与剂量成比例的增高(见下述药代动力学参数表)。
在肾移植受者每天用药每次 1.5 g,每日 2 次时,食物(27 g 脂肪,650 大卡热量)对吸收的程度无影响(根据 MPA 的 AUC)。但食物使 MPA 的 Cmax降低 40%(见【用法用量】)。
分布:在 12 例健康志愿者中静脉注射和口服的 MPA 的平均(±标准差)表观分布容积分别为 3.6(±1.5)和 4.0(±1.2)L/kg。在与临床相应的浓度,97% 的 MPA 与血浆白蛋白结合。该数值取决于肾脏功能;开始治疗后白蛋白结合情况发生变化可解释 MPA 药代动力学的非平稳性。在稳定期肾移植受者中 MPAG 正常浓度下,82% 的 MPAG 与血浆白蛋白结合;但 MPAG 的浓度升高时(见于肾功能异常和肾移植术后移植物功能延迟的患者),因为 MPAG 和 MPA 竞争与白蛋白结合,MPA 与白蛋白的结合下降。血和血浆的放射性浓度的平均比值约为 0.6,说明了 MPA 和 MPAG 没有广泛分布到血液的细胞成分。
在体外研究中评价了其他试剂对 MPA 与血清白蛋白或血浆蛋白结合的影响,水杨酸(在血清白蛋白中 25 mg/dL 时)和 MPAG(在血浆蛋白中 ≥ 460 μg/mL 时)可以增加游离 MPA 的比例。在超过临床中能遇到的浓度时,环孢素 A、地高辛、萘普生、强地松、心得安、免疫抑制剂、茶碱、甲苯磺丁脲和华法令均不增加游离 MPA 的比例。MPA 的浓度高达 100 μg/mL 时对华法令、地高辛和心得安与蛋白结合无影响,但使茶碱的结合由 53% 降低到 45%,使苯妥英钠的结合由 90% 降低到 87%。
代谢:口服或静脉给药后吗替麦考酚酯完全代谢为活性产物 MPA。口服给药后在全身吸收前就代谢为 MPA。MPA 主要通过葡萄糖醛酸转化酶形成酚化葡萄糖醛麦考酚酸(MPAG),后者无药理学活性。在体内,MPAG 通过肝肠循环被转化成 MPA。在健康志愿者口服本品后尿中也可检测到下列 2-羟基乙基吗啉成分:N-(2-羧基乙基)-吗啉、N-(2-羟基乙基)-吗啉和 N 端氧化的 N-(2-羟基乙基)-吗啉。
在服药后 6-12 小时后可观察到血浆 MPA 浓度的第二个峰值。同时服用消胆胺(4 g,每日 3 次),可以使 MPA 的 AUC 大约降低 40%(主要降低了 AUC 曲线的终末部分的药物浓度)。此现象提示了肝肠循环提高了 MPA 的血浆浓度。
肾损害患者的吗替麦考酚酯的代谢物血浆浓度升高,MPA 提高 50% 和 MPAG 提高 3 到 6 倍。
清除:只有少量以 MPA 形式从尿液中排出(不足剂量的 1%,可忽略)。口服放射标记的吗替麦考酚酯后,原有放射剂量可以完全回收,服用剂量的 93% 在尿中回收,6% 在粪便中回收。大多数(约 87%)药量以 MPAG 的形式从尿液中排出。在临床应用的浓度下,MPA 和 MPAG 通常不能通过血液透析清除。但是 MPAG 的血浆浓度升高(>100 μg/mL)时少量 MPAG 可通过血液透析清除。胆酸结合剂,如消胆胺,通过影响药物的肝肠循环可以降低 MPA 的曲线下面积(见【药物过量】)。
MPA 的半衰期和血浆清除率的平均值(±标准差)在口服给药分别为 17.9(±6.5)小时和 193(±48)mL/min,在静脉给药分别为 16.6(±5.8)小时和 177(±31)mL/min。
健康志愿者、肾脏移植、心脏移植和肝脏移植受者的药代动力学:下面用平均值(±标准差)表明 MPA 的药代动力学参数,包括健康志愿者本品一次给药的参数和肾脏移植和心脏移植和肝脏移植受者多次给药的参数。肾脏移植和肝脏移植受者在移植后的早期(移植后 40 天内)较移植后晚期(移植后 3-6 月)的 MPA AUC 大约低 20-41%,平均 Cmax低 32-44%。
在肾脏移植受者刚移植后静脉给予吗替麦考酚酯(每次 1 g,2 小时输完,每日 2 次,连用 5 天)的 MPA AUC 较口服同样剂量者高约 24%。在肝脏移植受者中静脉给予本品每次 1 g,每日 2 次,随后给予口服每次 1.5 g,每日 2 次的 MPA AUC 的平均值与肾脏移植后给予每次 1 g,每日 2 次相似。
健康志愿者(单次剂量)、肾脏移植和肝脏移植受者(多次给药)给予吗替麦考酚酯后的药代动力学参数
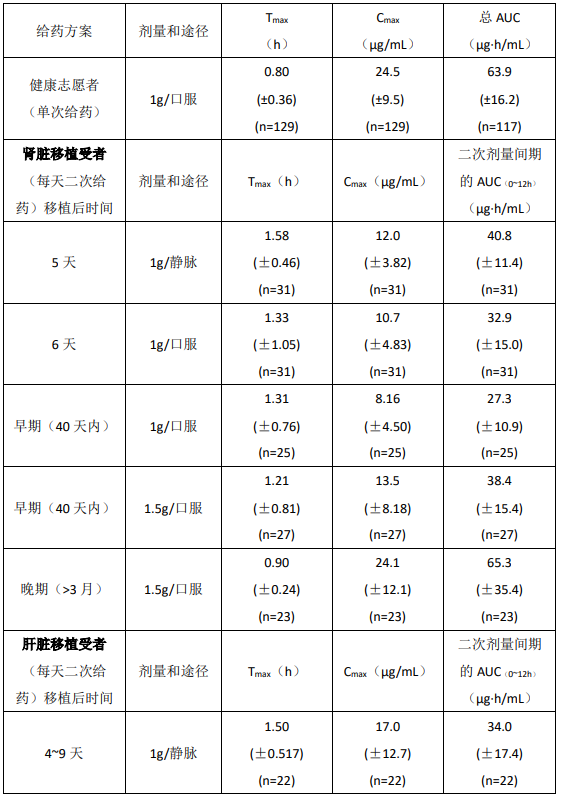
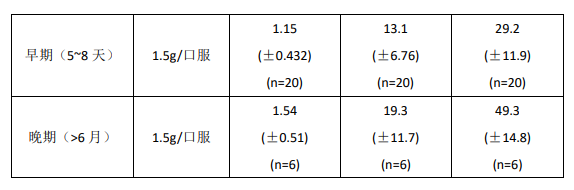
AUC(0-12 h)的数值是从 4 小时取样的数据中推断得到的,2 片 500 mg 的片剂与 4 片 250 mg 的片剂生物等效。
据国外文献报道,已经在狼疮性肾炎患者中,对吗替麦考酚酯的药代动力学进行了研究。 狼疮性肾炎患者中的 MPA 药代动力学特性与在移植患者中报告的类似(包括所观察到的活性药物暴露量的高度变异性),但由于不可预测的肾功能变化,狼疮性肾炎患者的药代动力学特征较复杂。
特殊人群的药代动力学:下面用平均值(±标准差)来表明在肾功能或肝功能异常的非移植受者单次口服本品的 MPA 的药代动力学参数。
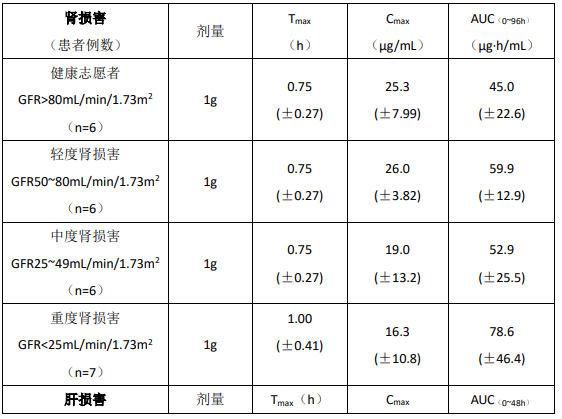
肾损害的患者
在一个单剂研究中(每组 6 人),重度慢性肾脏损害的志愿受试者(肾小球滤过率(GFR)小于 25 mL/min/1.73m2)的血浆 MPA 的 AUC 比正常健康志愿者轻度肾损害的志愿者(GFR>80 mL/min/1.73m2)高 28-75%。而且单次服用后,重度肾损害的志愿受试者 MPAG 的 AUC 比正常健康志愿者高 3-6 倍,这与我们已知的 MPAG 由肾脏消除一致。MPAG 长期增高的安全性尚无数据。
重度慢性肾脏损害者(GFR 小于 25 mL/min/1.73m2)单次静脉给药 1 g 的血浆 MPA AUC 为 62.4(±19.3)μg·h/mL(n = 4)。对重度慢性肾脏损害患者,多剂量吗替麦考酚酯的代谢情况尚未研究(见【注意事项】和【用法用量】)。伴重度肾损害的狼疮性肾炎患者研究数据有限,建议对 GFR<30 mL/min 的狼疮性肾炎患者进行治疗药物浓度监测。
肾移植术后移植物功能延迟的患者平均 MPA 的 AUC(0-12 h)与那些移植物功能正常的术后患者相类似。在出现移植物功能延迟的患者中有可能出现短暂的血浆 MPA 游离比例增高或浓度升高,但在出现移植物功能延迟的患者中并不需要进行剂量调整。肾移植术后移植物功能延迟的患者平均 MPAG 的 AUC(0-12 h)与那些移植物功能正常的术后患者相比高 2-3 倍(见【注意事项】和【用法用量】)。
在 8 例肾移植后原发性移植物无功能的患者中,28 天多次给药后血浆 MPAG 的浓度累积到 6-8 倍,MPA 的浓度累积到 1-2 倍。
吗替麦考酚酯的药代动力学并不因血液透析而改变。血液透析通常不能清除 MPA 和 MPAG。但是 MPAG 的血浆浓度升高(>100 μg/mL)时少量 MPAG 可通过血液透析。
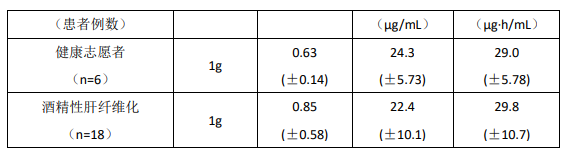
肝损害患者
18 例酒精性肝硬化和 6 例健康志愿者参加了单次剂量(1 g 口服)的研究,结果表明健康志愿者和酒精性肝硬化者的药代动力学参数相似,提示了肝脏对 MPA 的葡萄糖醛酸化过程相对不受肝实质疾病的影响。但是要注意到不知因何原因本试验中健康志愿者的 AUC 较其他试验的健康志愿者低 50%,这样使健康志愿者和酒精性肝硬化者之间很难比较。其他原因的肝脏疾病如原发胆汁性肝硬化可能产生不同效果。6 例因酒精性肝硬化而重度肝损害(氨基比林呼吸实验小于剂量的 0.2%)患者给予单次剂量(1 g 静脉给药),MMF 可以迅速转换为 MPA。MPA AUC 为 44.1(±15.5)μg·h/mL。
儿童(年龄 ≤ 18 岁)
在同种异体移植后接受了本品口服每次 600 mg/m2,每日 2 次治疗的 55 例儿童(1-18 岁)中评价了 MPA 和 MPAG 的药代动力学参数。MPA 的药代动力学参数见下表。
不同年龄和同种异体移植后不同时间的 MPA 的药代动力学参数(平均值±标准差)
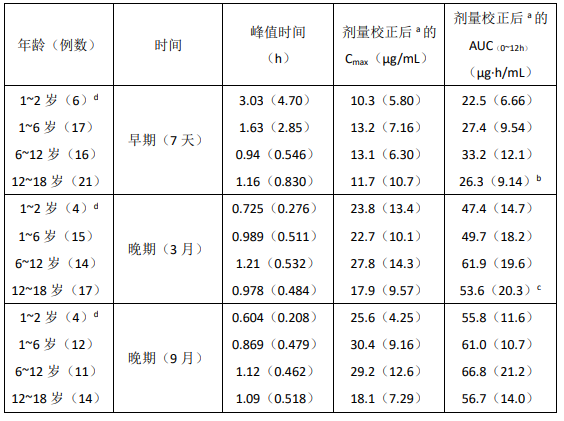
a剂量调整为相当于 600 mg/m2bn = 20cn = 16d一个亚组为 1-6 岁
儿童服用吗替麦考酚酯混悬液每次 600 mg/m2,每日 2 次(最大每次 1 g,每日 2 次)的平均 MPA AUC 值与成人肾移植后早期服用吗替麦考酚酯胶囊每次 1 g,每日 2 次相似。数据的变异率很大。在成人中观察到移植后早期的 MPA AUC 值是移植后晚期(>3 月)的 45%-53%。在 1-18 岁间的儿童,移植后早期和晚期的 MPA AUC 值相似。
目前尚未开展骁悉在儿童狼疮性肾炎患者中的药物代谢动力学研究。
性别
几个试验的数据汇总来观察 MPA 的药代动力学有无差别(剂量调整为相当于 1 g/m2)。男性和女性的 MPA AUC(1-12 h)值分别为 32.0±14.5(n = 79)和 36.5±18.8 μg·h/mL(n = 4);男性和女性的 MPA Cmax分别为 9.96±6.19 和 10.6±5.64 μg/mL。差异无临床意义。
老人
与年轻移植受者相比,尚未发现老年移植受者的吗替麦考酚酯及其代谢物的药代动力学发生变化。
【临床试验】
多个随机双盲多中心的试验研究了本品和强地松、环孢素 A 联合应用对移植器官排斥反应的安全性和有效性,其中肾移植试验 3 个和成人肝移植试验 1 个。一个随机开放多中心注册试验研究了本品和强地松、他克莫司合用预防肝移植器官排斥反应的安全性和有效性。
肾脏移植
3 个试验中比较了 2 个剂量(每次 1 g,每日 2 次和每次 1.5 g,每日 2 次)的口服本品与硫唑嘌呤对预防急性排斥事件的作用,均与环孢素 A 和强的松联合应用。其中 1 个试验应用抗胸腺球蛋白治疗。这些试验在不同的单位进行,1 个包括美国的 14 个研究单位,1 个包括了欧洲的 20 个研究单位,1 个包括欧洲、加拿大和澳大利亚的 21 个研究单位。
主要的疗效指标是移植后最初 6 月内治疗失败的每个治疗组的患者比例,治疗失败定义为活检证实的急性排斥反应、发生死亡、移植失败或无活检证实排斥反应但因其他任何原因提前中断研究的情况。本品与抗胸腺球蛋白治疗(1 个试验)和环孢素 A/强的松(所有 3 个试验)联合方案与下列治疗方案进行了比较:
1. 抗胸腺球蛋白/硫唑嘌呤/环孢素 A/强的松,
2. 硫唑嘌呤/环孢素 A/强的松,
3. 环孢素 A/强的松。
本品和环孢素 A/强的松联合方案能降低移植后最初 6 个月内的治疗失败的发生率。下表总结了这些试验的结果。这些表格显示了治疗失败患者的比例,活检证实的发生急性排斥反应患者的比例,除死亡和移植失败且无活检证实排斥反应外的由于其他任何原因提前中断研究的患者比例。提前中断研究的患者要随访死亡和移植失败情况,累积死亡和移植失败发生率单独总结。提前中断研究的患者不随访终止研究后的排斥反应的发生情况。本品治疗组除死亡和移植失败且无活检证实排斥反应外的由于其他任何原因提前中断研究的患者比例高于对照组,在本品 3 g/d 组最高。因此急性排斥反应的比例可能会被低估,尤其在本品 3 g/d 组。
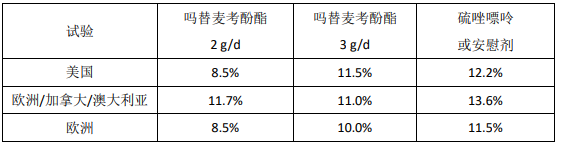
肾脏移植试验治疗失败的发生率(活检证实的排斥反应或因其他任何原因早期中断研究)
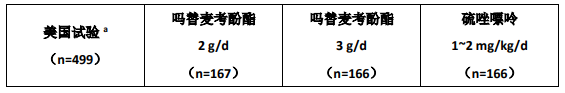
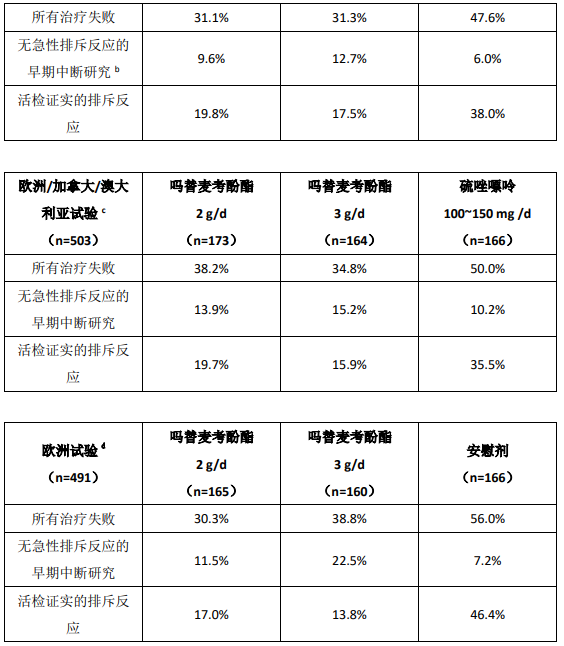
a抗胸腺球蛋白/吗替麦考酚酯或硫唑嘌呤/环孢素 A/强的松b不包括因死亡或移植失败而早期终止研究的病例c吗替麦考酚酯或硫唑嘌呤/环孢素 A/强的松d吗替麦考酚酯或安慰剂/环孢素 A/强的松
12 月时累积移植物丢失或死亡发生率总结如下:尚未发现本品治疗在移植失败或患者死亡方面的优势。在数据上,3 个试验均表明本品 2 g/d 或 3 g/d 治疗组的患者临床结果好于对照组,3 个试验中的 2 个表明本品 2 g/d 治疗组的患者临床结果好于 3 g/d 治疗组。所有治疗组中提前终止本品治疗的患者在移植物丢失和 1 年死亡率方面均较差。
肾脏移植试验累积移植物丢失和和 12 月时患者死亡率
儿童
一项开放的安全性和药代动力学研究在美国(9 个中心)、欧洲(5 个中心)和澳大利亚(1 个中心)完成,100 例儿童(3 月-18 岁)服用本品口服混悬液每次 600 mg/m2,每日 2 次(最大至每次 1 g,每日 2 次)和环孢素 A/强的松预防肾脏的同种异体肾移植的排斥反应。儿童患者可很好耐受本品(见【不良反应】),药代动力学方面与成人口服本品每次 1 g,每日 2 次相类似(见【药代动力学】)。各年龄组(3 月-6 岁、6-12 岁和 12-18 岁组)的活检证实的排斥反应相类似。6 月时总的活检证实的排斥反应比例与成人相类似。移植后 12 月时移植物丢失(5%)或死亡发生率(2%)与成人肾脏移植受者相似。
肝脏移植
一项关于肝脏移植受者的双盲随机平行对照的多中心试验在美国的 16 个中心、加拿大的 2 个中心、欧洲的 4 个中心和澳大利亚的 1 个中心完成。总共入组 565 例患者。根据试验方案,患者先接受静脉本品每次 1 g,每日 2 次至 14 天,然后接受口服本品每次 1.5 g,每日 2 次,或先接受静脉硫唑嘌呤 1-2 mg/kg/d,然后口服硫唑嘌呤 1-2 mg/kg/d,同时联合应用环孢素 A/强的松作为维持性免疫抑制治疗,实际上试验中最初口服硫唑嘌呤的中位值是 1.5 mg/kg/d(范围为 0.3-3.8 mg/kg/d),1 年时的口服硫唑嘌呤的中位值是 1.26 mg/kg/d(范围为 0.3-3.8 mg/kg/d)。
两个主要的疗效指标是:
1. 移植后最初的 6 月内有一次或多次活检证实并需要治疗的排斥反应、死亡或再次移植的患者比例;
2. 移植后最初 12 月内移植失败的患者比例。提前退出治疗的患者要随访 12 月内的同种移植排斥发生率和移植失败(死亡或再次移植)的发生率。
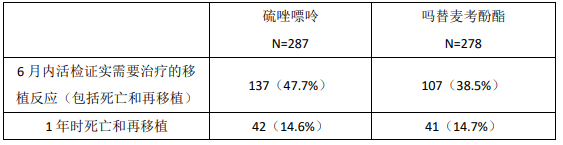
结果:在 ITT 人群,与环孢素 A/强的松联合应用,本品较硫唑嘌呤更能降低 6 个月内的急性排斥反应发生率,而 1 年时的死亡和再移植的发生率相似。
6 月内的排斥反应/12 月内的死亡或再次移植
一项关于肝脏移植受者的随机、多中心、开放注册试验在中国的 9 个中心完成。总共入组 64 例平均年龄 46 岁的良性终末期肝病接受首次肝移植的患者。根据伯明翰大学外科 130 名肝移植病人临床接受两种不同的免疫抑制方案(本品 + 低剂量他克莫司 + 糖皮质激素和他克莫司 + 糖皮质激素)的回顾性研究(论证了以他克莫司为基础方案增加本品能明显减少同种异体肝移植急性排斥反应的发生率:本品 + 低剂量他克莫司 + 糖皮质激素组:26.0%,他克莫司 + 糖皮质激素组:45.0%,并且能明显减少他克莫司的剂量,以及能减少肾毒性的发生)的基础上,设计本试验方案,治疗组患者 31 例接受本品片剂 0.5-1.0 g,每日 2 次,同时联合应用他克莫司/强的松作为维持性免疫抑制治疗(剂量的选择,按照中国人群的临床要求);对照组患者 33 例联合应用他克莫司/强的松作为维持性免疫抑制治疗。
两个主要的疗效指标是:
1. 评价以他克莫司为基础方案增加本品(0.5-1.0 g,每日 2 次,空腹,口服至 12 周)预防急性排斥的疗效;
2. 观察肝移植后 12 周内急性排斥反应的发生率、程度。
两个次要的疗效指标是:
1. 急性排斥反应中使用 OKT3、ATG、ALG 治疗的患者人数;
2. 在研究过程中活检证实为急性排斥反应的次数。
在 12 周研究过程中出现的急性排斥反应数 5 例,占 9.6%,均经活检证实,其中治疗组 1 例,属轻度急排,占 3.6%,对照组 4 例,2 例属轻度急排,1 例中度急排,1 例重度急排,占 16.7%。5 例急排中 4 例在甲基强的松龙冲击,1 例在增大他克莫司剂量的治疗后得到缓解或控制。
结果:
1. 本品对肝移植术后急性排斥反应的预防有效:整个试验入选 64 例患者,出现的急性排斥反应数 5 例,对照组的急排发生率是治疗组的 4.6 倍。
2. 本品没有明显的肝、肾毒性:在不良事件中,转氨酶升高 4 例,治疗组与对照组各 2 例,3 例与他克莫司有关,4 例均与本品无关;治疗组在术后 4 周转氨酶水平显著低于对照组,两组的其他治疗没有差别;说明本品对肝脏无明显毒性,具有良好地保护术后早期移植肝的作用。两组从血肌酐、尿素氮水平看,在各个时间段均无显著性差异,也就是说,增加本品后,不增加肾损害。
3. 本品可引起肝移植术后部分患者消化系统症状,但停药后可消失:本试验 64 人中 24 人出现消化系统症状和体征(恶心、呕吐、腹痛、腹胀、腹泻、食欲不振、体重减轻、胆道并发症),其中与药物可能有关的主要为恶心、呕吐、腹痛、腹胀、腹泻、食欲不振。这些症状在停用本品或不需处理后均缓解,无严重的后果。
4. 未发现本品有致命性的副作用。
狼疮性肾炎研究:
吗替麦考酚酯片在国外进行的研究-全球多中心 ALMS 随机开放性试验。这是一项前瞻性随机对照全球多中心研究,纳入患者共来自 20 个国家 88 个中心。该研究为 2 阶段设计,分别评估吗替麦考酚酯(MMF)在狼疮性肾炎的诱导期和维持期治疗的疗效与安全性。
1. 诱导期研究
24 周诱导期治疗纳入 370 例根据国际肾脏病学会/肾脏病理学会分类诊断(ISN/RPS)III、IV 或 V 型狼疮性肾炎患者,所有患者被随机分配接受 MMF 口服片剂(目标剂量 3 g/日)或环磷酰胺(CTX)静脉输注(0.5-1.0 g/m2)每月一次共给药 6 个月,每组各 185 例受试者。两组患者均合并使用泼尼松口服片剂,泼尼松起始剂量 0.75-1.0 mg/kg/天(最大 60 mg/ 天),可根据患者病情逐渐减少泼尼松剂量,研究显示两组激素用量无显著统计学差异。主要有效性终点是预先定义的尿蛋白/肌酐比值降低和血清肌酐达到稳定水平或出现改善。次要终点包括肾脏完全缓解、全身疾病活动性和损害以及安全性。
疗效结果
两组间的缓解率无显著统计学差异,MMF 组共 104 例(56.2%)患者治疗后达到缓解, CTX 组中共 98 例(53.0%)患者治疗后达到缓解。两组间的次要终点指标均无显著统计学差异。两组间不同病理类型狼疮性肾炎患者的缓解率未出现显著统计学差异。
2. 维持期研究
在 ALMS 研究的维持治疗期内,共 227 例经 MMF 诱导治疗后达到缓解的患者被随机分配接受维持治疗,116 例患者接受 MMF 口服片剂(目标剂量 2.0 g/日);111 例患者接受硫唑嘌呤(AZA)口服胶囊剂(2.0 mg/kg/日)。最终,MMF 治疗组和 AZA 治疗组的平均(± SD)剂量分别为 1.87±0.43 g 和 119.7±47.91 mg。大多数接受 MMF 的患者达到了目标剂量(2 g/日),并继续参与研究的维持治疗部分,直至完成计划的 36 个月研究,平均治疗持续时间为 2.3 年;平均日剂量达到 MMF 目标剂量的 80% 或以上的患者比例为 79.7%。主要有效性终点是至治疗失败时间,治疗失败定义为死亡、终末期肾病、血清肌酐水平倍增、肾病复发或狼疮性肾炎的补救治疗。
疗效结果
在主要终点至治疗失败时间方面(风险比为 0.44;95% 置信区间,0.25-0.77;p = 0.003)以及至肾病复发时间和至补救治疗时间方面(风险比 < 1.00;p<0.05),MMF 治疗组优于 AZA 治疗组。MMF 治疗组和 AZA 治疗组中观察到的治疗失败发生率分别为 16.4%(19/116 例患者)和 32.4%(36/111 例患者)。
【毒理研究】
遗传毒性:
吗替麦考酚酯小鼠淋巴瘤/胸腺嘧啶激酶试验和小鼠体内微核试验结果阳性,微生物突变分析、酵母菌基因转化分析和中国仓鼠卵巢细胞染色体畸变试验结果阴性。
生殖毒性:
吗替麦考酚酯在 20 mg/kg/d 时对雄性大鼠的生育力未见明显影响,根据体表面积推算,为临床推荐用于肾脏移植剂量的 0.1 倍,心脏移植剂量的 0.07 倍。在雌性大鼠的生殖和生育试验,吗替麦考酚酯剂量为 4.5 mg/kg/d 时未见母鼠出现毒性反应,F1 代可见畸形(主要为头和眼),为临床推荐用于肾脏移植剂量的 0.02 倍,心脏移植剂量的 0.01 倍。未见对 F1 代或后代生育力的明显影响。
致癌性:
小鼠经口给予吗替麦考酚酯 104 周,剂量达 180 mg/kg/日,未见致癌性,为临床推荐用于肾脏移植剂量(2 g/d)的 0.5 倍,心脏移植剂量(3 g/d)的 0.3 倍。大鼠经口给予 104 周,剂量达 15 mg/kg/日,未见致癌性,为临床推荐用于肾脏移植剂量的 0.08 倍,心脏移植剂量的 0.05 倍。
【化学成份】
化学名称:(E)-6-(4-羟基-6-甲氧基-7-甲基-3-氧代-1,3-二氢异苯并呋喃-5-基)-4-甲基-4-己烯酸 2-(吗啉-4-基)乙酯
化学结构式:
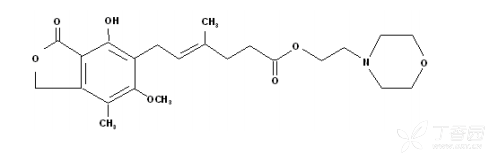
分子式:C23H31NO7
分子量:433.49
【上市许可持有人】
上海罗氏制药有限公司
【生产企业】
上海罗氏制药有限公司
信息来源:丁香园用药助手