【用法用量】
一般信息
如需用其他生物制品替换奥妥珠单抗,应事先获得处方医师同意。
奥妥珠单抗应通过专用输液管静脉输注给药,并应在配备完善的急救复苏设施的情况下由至少一名经验丰富的医生密切监督使用。奥妥珠单抗输注不应以静脉推注的方式给药,应使用 0.9%氯化钠溶液作为输注溶媒(见使用、操作和处置的特殊说明)。
肿瘤溶解综合征(TLS)的预防及用药:
肿瘤负荷高和/或肾功能受损(CrCl <70 mL/min)的患者存在TLS 风险,应接受预防性治疗。依据标准操作指南,开始奥妥珠单抗输注前的预防性治疗应包括充分水化和给予抑制尿酸的药物(例如别嘌醇)或尿酸氧化酶(例如拉布立酶)等适用的替代药物(见【注意事项】)。如果医生认为有必要,患者应在后续每次输注前继续接受预防性治疗。
输液相关反应(IRR)的预防及用药
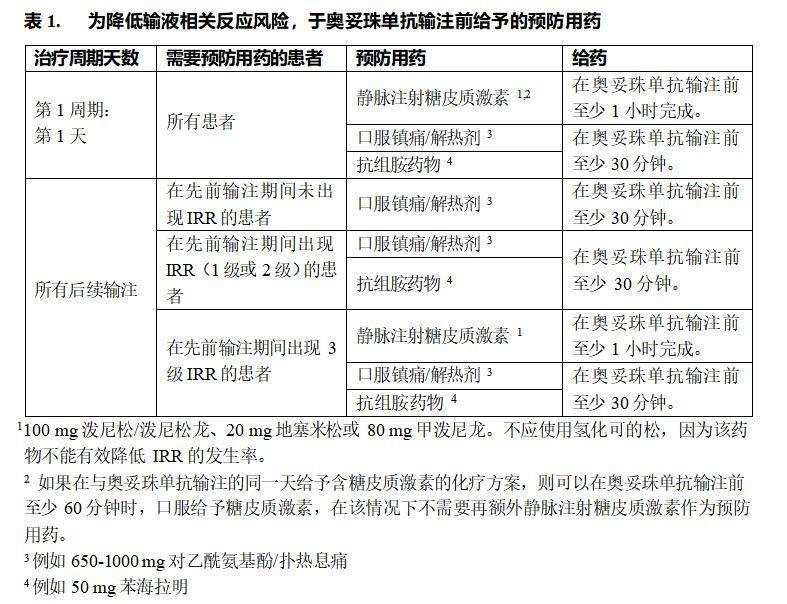
表1列出了降低输液相关反应风险的预防药物(见【注意事项】)。
在奥妥珠单抗静脉输注过程中IRR 的可能症状包括低血压。因此,在每次奥妥珠单抗输注前12小时以及输注期间和输注后1小时内,应考虑暂停使用降压药(见【注意事项】)。
输液相关反应(IRR)的预防及用药
标准剂量
奥妥珠单抗的推荐剂量为静脉给予 1000 mg,如表 2 所示。
对于初治的滤泡性淋巴瘤患者,奥妥珠单抗应按如下方式与化疗联合给药:
● 6 个周期,每个周期 28 天,与苯达莫司汀联合给药 1,或
● 6 个周期,每个周期 21 天,与 CHOP 联合给药,然后增加 2 个周期的奥妥珠单抗单药治疗,或
● 8 个周期,每个周期 21 天,与CVP 联合给药。
经过最初 6 或 8 个周期奥妥珠单抗与化疗的联合治疗,达到完全或部分缓解的患者应继
续接受奥妥珠单抗(1000 mg)单药维持治疗,每 2 个月 1 次,直至疾病进展或最长达 2 年。
单药维持治疗在诱导治疗期最后一次奥妥珠单抗给药后大约 2 个月开始。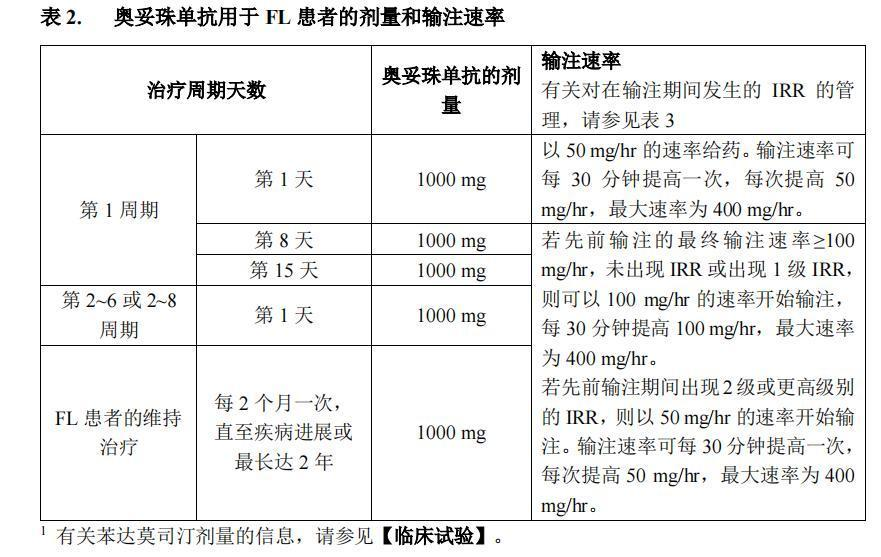
奥妥株单抗用于FL患者的剂量盒输注速率
延迟或遗漏给药
如果计划的奥妥珠单抗用药出现遗漏,应尽快给药;不要跳过该次给药或等到下一次计划的给药时间。
如果在第1周期的第8天或第1周期的第15天之前发生了毒性反应,则需要延迟给药,应在毒性反应恢复后给予这些剂量。在这种情况下,所有后续访视和第2周期的开始均将根据第1周期中的延迟情况进行调整。在奥妥珠单抗和化疗联合治疗期间,调整给药计划时应保持化疗周期之间的时间间隔。
在维持治疗期间,后续给药依照原定方案给药。治疗期间的剂量调整不建议降低奥妥珠单抗的剂量。
对于不良事件的症状(包括IRR)管理,请参见下表3和【注意事项】。
针对输液相关反应的输注速率调整指南
特殊人群
肝功能不全:尚未确立奥妥珠单抗在肝功能受损患者中的安全性和有效性。肾功能不全在轻度或中度肾功能受损患者中(CrCl 30-89mL/min),无需进行剂量调整。尚未在 CrCl<30mL/min 的患者中对奥妥珠单抗的安全性及有效性进行研究(参见【肾功能受损患者】和【药代动力学】特殊人群中的药代动力学)。
老年人:在年龄≥ 65 岁的患者中不建议进行剂量调整(参见【老年用药】)。儿童尚未确立奥妥珠单抗在 18 岁以下患者中的安全性和有效性。
【注意事项】
输液相关反应(IRR)
奥妥珠单抗治疗患者中最常见的药物不良反应(ADR)是输液相关反应,主要发生在首个 1000 mg 剂量的输注期间。IRR 可能与细胞因子释放综合征有关,奥妥珠单抗治疗患者中也有相关报告。必须遵循减少IRR 的缓解措施(见【用法用量】)。输液相关症状的发生率和严重程度在第一次 1000 mg 剂量输注后会明显降低,大部分患者在奥妥珠单抗后续给药期间不再发生IRR(见【不良反应】)。
在大多数患者中,无论适应症,输液相关反应均为轻度至中度,而且可以通过减慢或暂停首次输液来控制,但是同时也报告了需要对症治疗的重度和危及生命的输液相关反应。在临床上,可能难以区分IRR 和 IgE 介导的过敏反应(例如,速发过敏反应)。高肿瘤负荷的患者发生重度IRR 风险增加。肾功能不全患者(CrCl<50mL/min)IRR 发生风险更高,包括重度IRR 有关预防性治疗的信息,请参见【用法用量】;有关如何基于反应级别管理 IRR 的信息,请参见表 3 针对输液相关反应的输注速率调整指南。
如果出现以下情况,患者不得接受进一步的奥妥珠单抗输注:

输液相关反应(IRR)
应在整个输注期间及输注后对伴有心脏病或肺病的患者进行密切监测。奥妥珠单抗静脉输注过程中可能会出现低血压,因此,在每次奥妥珠单抗输注前 12 小时以及输注期间和输注后 1 小时内,应考虑暂停使用降压药。对于有急性高血压危象风险的患者,应评价其停用降压药的获益和风险。
超敏反应
在接受奥妥珠单抗治疗的患者中曾报告过速发(例如,速发过敏反应)和延迟发作的(例如,血清病)超敏反应。临床上可能难以鉴别超敏反应与输液相关反应,超敏反应症状一般出现在既往暴露之后,而且首次输注时非常罕见。如果在输注过程中或输注后疑似出现超敏反应,则应停止输注,并永久终止治疗。已知对奥妥珠单抗有超敏反应的患者不得接受治疗(见【禁忌】)。
肿瘤溶解综合征(TLS)
已报告使用奥妥珠单抗后可发生肿瘤溶解综合征(TLS)。被认为有 TLS 风险的患者 [例如,肿瘤负荷高和/或肾功能受损(CrCl <70 mL/min)患者] 应接受预防性治疗。如在【用法用量】中所述,预防治疗应在奥妥珠单抗给药前的 12-24 小时内开始,包括充分水化和给予抑制尿酸的药物(例如,别嘌醇)或尿酸氧化物(例如,拉布立酶)等适用的替代药物。在最初几天的治疗期间应仔细监测认为有风险的所有患者,特别关注肾功能、钾和尿酸值。应遵循符合规范的其他任何指导原则。TLS 的治疗包括纠正电解质异常、监测肾功能和液体平衡以及给予支持治疗,包括根据需要进行透析。
中性粒细胞减少症
已报告在接受奥妥珠单抗治疗期间可出现重度和危及生命的中性粒细胞减少症,包括发热性中性粒细胞减少症。应通过定期实验室检查密切监测出现中性粒细胞减少症的患者直至恢复。如有必要进行治疗,应当按照当地的指南考虑给予粒细胞集落刺激因子(G-CSF)。任何迹象显示伴随感染即应给予相应治疗。严重或危及生命的中性粒细胞减少症应考虑延迟奥妥珠单抗给药。强烈建议重度中性粒细胞减少症持续超过 1 周的患者在治疗期间接受预防
性抗菌治疗直至恢复至 1 或 2 级,抗病毒和抗真菌也应考虑。可能会发生迟发性(在治疗结束后 28 天后发生)或持续性中性粒细胞减少症(在治疗完成/停用后,持续超过 28 天)。肾功能损伤患者(CrCl<50mL/min)发生中性粒细胞减少症风险增加。
血小板减少症
在奥妥珠单抗治疗期间,曾观察到重度和危及生命的血小板减少症,包括急性血小板减少症(发生在输注后的 24 小时内)。肾功能损伤患者(CrCl<50mL/min)发生血小板减少症风险增加。在血小板减少症与出血事件之间,尚未确立明确的关系。
应密切监测患者是否发生血小板减少症,特别是在第 1 周期期间;应定期进行实验室检查直到恢复,如果发生重度或危及生命的血小板减少症,应考虑延迟给药。主治医生可酌情依据机构的临床实践给予血液制品输注(即血小板输注)。任何可能加重血小板减少症相关事件的伴随用药,例如血小板抑制剂和抗凝剂,都应慎用,特别是在第 1 周期期间。
既有心脏疾病加重
在有基础心脏疾病的患者中,已经报告了在接受奥妥珠单抗治疗期间发生心律失常(如房颤和快速性心律失常)、心绞痛、急性冠脉综合征、心肌梗死和心力衰竭(见【不良反应】)。这些事件可能表现为IRR 的部分症状,并且可能致死。因此,应当密切监测有心脏病史的患者。此外,这些患者应谨慎水化,以防止可能出现的液体过多。
感染不应在有活动性感染的情况下给予奥妥珠单抗,对于有反复感染或慢性感染史的患者,应慎用奥妥珠单抗。奥妥珠单抗治疗期间以及治疗结束后可能发生严重的细菌性、真菌性,以及新发病毒性感染或病毒再激活性感染。曾有过致死性感染的报告。
在 FL 研究中,包括随访期在内的所有研究阶段均观察到感染发生率升高,其中在维持阶段观察到的感染发生率最高。随访期间,在诱导期接受了奥妥珠单抗+苯达莫司汀治疗的患者中观察到了更多的3~5级感染。
乙型肝炎病毒再激活
接受抗 CD20 抗体(包括奥妥珠单抗)治疗的患者,可能会发生乙型肝炎病毒(HBV)再激活,某些情况下会导致暴发性肝炎、肝功能衰竭和死亡(见【不良反应】)。
开始奥妥珠单抗治疗之前,应该在所有患者中进行乙型肝炎病毒(HBV)筛查, 至少应包括HBsAg 和HBcAb 检查。可以根据当地指导原则适当补充检测其他标志物。活动性乙型肝炎患者不应该接受奥妥珠单抗治疗。在治疗开始之前,血清学阳性的乙型肝炎患者应咨询肝病专家,并且应按照当地医疗规范接受监测和管理,以预防肝炎病毒再激活。
进行性多灶性脑白质病(PML)
在接受奥妥珠单抗治疗的患者中有发生 PML 的报告(见【不良反应】)。当任何患者出现新发神经系统症状或原有神经系统表现改变时,均应考虑PML 诊断。PML 的症状不具有特异性,随着脑受累区域的不同而有所差异。常见皮质脊髓束受损的运动症状(例如,肌无力、瘫痪和感觉障碍)、感觉异常、小脑症状和视野缺损。可能会发生“皮质性”的体征/症状(例如,失语症或视觉-空间定向障碍)。PML 的评估包括但不限于,神经科专家会诊、脑磁共振成像(MRI)和腰椎穿刺术(脑脊液JC 病毒 DNA 检测)。奥妥珠单抗治疗应在可疑PML 检查期间暂停,且在确认为 PML 后永久停药。所有合并使用的化疗或免疫抑制治疗也应考虑停用或减量。应将患者转诊至神经科专家处进行PML 的评估和治疗。
免疫接种
尚未研究奥妥珠单抗治疗后接种活病毒疫苗或减毒疫苗的安全性,因此不建议在治疗期间以及B 细胞恢复前接种活病毒疫苗。
奥妥珠单抗宫内暴露与使用活病毒疫苗进行婴儿疫苗接种:在妊娠期间曾接受过奥妥珠单抗治疗的母亲所生育的婴儿中可能会出现 B 细胞耗竭,应监测婴儿 B 细胞耗竭情况,并推迟活病毒疫苗的接种,直至婴儿的 B 细胞计数恢复。应与婴儿的医生讨论接种活病毒疫苗的安全性和时间安排。(见【孕妇及哺乳期妇女用药】,妊娠期)。
肾功能受损患者
在 iNHL 患者的关键研究中,分别有 6.9%的患者(GAO4753g:14/204 例)和 5%的患者(BO21223:35/698 例)伴有中度肾功能受损(CrCl < 50 mL/min)。这些患者发生的严重不良事件、3~5 级不良事件和导致终止治疗的不良事件(仅研究 BO21223 中的患者)多于那些 CrCl ≥ 50 mL/min 的患者(见特殊剂量指导和特殊人群中的药代动力学)。研究排除了 CrCl < 40 mL/min 的患者(见【临床试验】。
驾驶和操作机器的能力
尚未开展过有关奥妥珠单抗对驾驶和机械操作能力影响的研究。对于出现输液相关症状的患者,建议在症状消退之前,不要驾驶和操作机器。
【孕妇及哺乳期妇女用药】
妊娠:
应避免在妊娠期间使用奥妥珠单抗,除非对母亲的潜在获益超过对胎儿的潜在风险。对于在妊娠期间曾接受过奥妥珠单抗治疗的母亲所生育的婴儿,应考虑推迟减毒活疫苗的接种,直至婴儿的B细胞水平在正常范围内。
尚未在妊娠女性中进行过研究。动物试验参见【药理毒理】,生殖毒性。
分娩:无可报告的数据。
哺乳:由于IgG 能分泌至母乳中,而且尚不清楚婴儿吸收的可能性和对婴儿的危害,应该建议哺乳女性在奥妥珠单抗治疗期间和在奥妥珠单抗末次给药之后 18 个月内停止哺乳(见【药代动力学】,消除)。动物研究已经显示了奥妥珠单抗能分泌至乳汁中(见【药理毒理】,生殖毒性)。
避孕:有生育能力的女性在奥妥珠单抗治疗期间和在奥妥珠单抗治疗之后 18 个月内应使用有效的避孕措施(见【药代动力学】,消除)。
【儿童用药】
尚未确立奥妥珠单抗在 18 岁以下患者中的安全性和有效性。
老年用药
在 iNHL 患者的关键研究中,年龄为 65 岁或以上的患者发生的严重不良事件和导致退出或死亡的不良事件多于年龄< 65 岁的患者。在有效性方面未观察到显著临床差异。