与来那度胺和地塞米松联用,治疗已接受过至少一种既往治疗的多发性骨髓瘤成人患者。
【成份】
本品主要成份:枸橼酸伊沙佐米
2.3mg:每粒胶囊含3.3 mg枸橼酸伊沙佐米,相当于2.3 mg伊沙佐米
3mg:每粒胶囊含4.3 mg枸橼酸伊沙佐米,相当于3 mg伊沙佐米
4mg:每粒胶囊含5.7 mg枸橼酸伊沙佐米,相当于4 mg伊沙佐米
本品为浅粉色胶囊(2.3mg)、浅灰色胶囊(3mg)或浅橙色(4mg)胶囊,囊壳上印有标识“ Takeda”及规格,内容物为白色粉末。 [1-2]
【适应症】
与来那度胺和地塞米松联用,治疗已接受过至少一种既往治疗的多发性骨髓瘤成人患者。
【规格】
按C14H19BCl2N2O4计,(1)2.3mg,(2)3mg,(3)4mg
【药物相互作用】
药代动力学相互作用:
CYP抑制剂
伊沙佐米与克拉霉素联用(一种CYP3A强效抑制剂),未导致伊沙佐米的全身暴露产生有临床意义的变化。伊沙佐米 Cmax下降4%,AUC上升11%。因此,伊沙佐米和CYP3A强效抑制剂联合给药无需进行剂量调整。
根据一项群体PK分析的结果,伊沙佐米与CYP1A2强效抑制剂联用未导致伊沙佐米的全身暴露产生有临床意义的变化。因此,伊沙佐米和CYP1A2强效抑制剂联合给药无需进行剂量调整。
CYP诱导剂
伊沙佐米与利福平联合给药,伊沙佐米 Cmax下降54%,AUC下降74%。因此,不建议伊沙佐米与CYP3A强效诱导剂联合给药(见【注意事项】)。
伊沙佐米对其他药品的影响
伊沙佐米既不是可逆的,也不是时间依赖性的CYPs 1A2、2B6、2C8、2C9、2C19、2D6或3A4/5的抑制剂。伊沙佐米不诱导CYP1A2、CYP2B6和CYP3A4/5活性或相应免疫反应性蛋白水平。预计伊沙佐米不会通过CYP诱导或抑制而产生药物相互作用。
基于转运蛋白的相互作用
伊沙佐米是P-gp的低亲和力底物。伊沙佐米不是BCRP、MRP2或肝OATP的底物。伊沙佐米不是P-gp、BCRP、MRP2、OATP1B1、OATP1B3、OCT2、OAT1、OAT3、MATE1或MATE2-K的抑制剂。预计伊沙佐米不会产生转运蛋白介导的药物间相互作用。
口服避孕药:
当伊沙佐米与地塞米松(已知是CYP3A4、其他酶和转运蛋白的一种弱效至中效诱导剂)联合给药时,需考虑口服避孕药疗效降低的风险。使用激素避孕的女性还需采用屏障避孕。
【药物过量】
尚无已知的用于伊沙佐米过量的特效解毒剂。虽然临床数据有限,但在随机化对照试验中已报告了剂量≤12 mg的数据。如发生药物过量,应监测患者的不良反应(见【不良反应】)并提供相应的支持性治疗。
【临床试验】
在一项国际、随机化、双盲、安慰剂对照、多中心、III期优效性研究(C16010)中评价了接受过至少一种既往治疗的复发和/或难治性多发性骨髓瘤患者接受伊沙佐米联合来那度胺和地塞米松治疗的疗效和安全性。总共722例患者(意向治疗 [ITT] 人群)以1: 1的比例被随机分配接受伊沙佐米联合来那度胺和地塞米松(N=360;伊沙佐米治疗方案组)或安慰剂联合来那度胺和地塞米松(N=362;安慰剂治疗方案组)治疗,直至疾病进展或出现不可耐受的毒性。试验入组了原发性难治性、既往治疗后复发或对任何既往治疗难治且已复发的多发性骨髓瘤患者。其中疾病进展前改变治疗方案,以及心血管异常状况得到控制的患者亦可以入组。这项III期研究不包括对来那度胺或蛋白酶体抑制剂耐药的患者和接受过3线以上既往治疗的患者。根据本研究的目的,将难治性,即耐药定义为,疾病在治疗中出现进展或在使用末剂来那度胺或蛋白酶体抑制剂后60天内出现进展。由于此类对来那度胺或蛋白酶体抑制剂耐药患者的数据有限,在开始伊沙佐米治疗之前,建议先进行仔细的风险-获益评估。
建议两个治疗组中的所有患者按照来那度胺药品说明书进行血栓预防治疗。由医生决定给予患者伴随用药,如止吐药、抗病毒药和抗组胺药,用于预防和/或治疗症状。
在28天周期中,患者在第1、8和15天口服伊沙佐米4mg或安慰剂,在第1-21天口服来那度胺(25mg),在第1、8、15和22天口服地塞米松(40mg)。肾损害患者根据来那度胺药品说明书调整起始剂量。治疗持续至疾病进展或出现不可耐受的毒性。
两种治疗方案组的基线人口统计学和疾病特征均衡且相当。中位年龄66岁,范围38-91岁;58%的患者年龄大于65岁。57%的患者是男性。研究人群中,85%为白人,9%为亚洲人,2%为黑人。 93%的患者ECOG体力状态评分为0-1,12%的患者基线ISS分期是III期(N=90)。25%的患者肌酐清除率<60 mL/min。23%的患者为轻链型,12%的患者的可测量病变仅为游离轻链。19%是细胞遗传学异常的高风险患者(del[17],t[4; 14],t[14; 16])(N=137)、10%存在del(17)异常(N=69)和34%存在1q扩增 (1q21)(N=247)。患者接受过1-3线既往疗法(中位值1),既往治疗中包括硼替佐米(69%)、卡非佐米(<1%)、沙利度胺(45%)、来那度胺(12%)、美法仑(81%)。57%的患者接受过既往干细胞移植。77%的患者在既往治疗后复发,11%是既往难治性患者。原发难治性在患者中占6%,定义为对所有既往治疗的最佳疗效为疾病稳定或疾病进展。
根据2011年国际骨髓瘤工作组(IMWG)共识统一疗效标准,由一个盲态的独立审查委员会(IRC)根据中心实验室结果进行疾病评估,主要终点为无进展生存期(PFS)。每4周评估一次疾病状况,直至疾病进展。在主要分析时(中位随访最长14.7个月,治疗周期中位数为13个周期),PFS在治疗组间存在统计学显著性的差异。PFS结果总结于表5和图1。伊沙佐米治疗方案组总体缓解率的改善为PFS的改善提供了支持。
表5:多发性骨髓瘤患者接受伊沙佐米或安慰剂与来那度胺和地塞米松联合治疗后的无进展生存期和缓解结果(意向治疗人群)
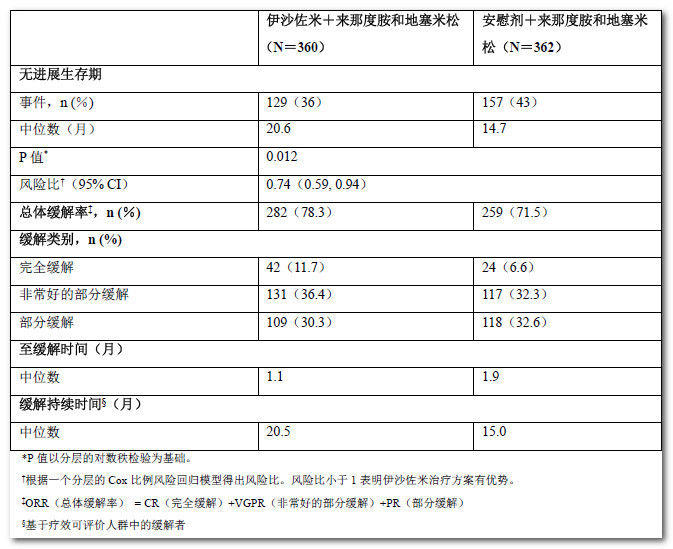
图1:意向治疗人群中无进展生存期的Kaplan-Meier曲线
在一项计划(于中位随访第23个月)进行的总生存期(OS)中期分析中,死亡人数占ITT人群中最终OS分析所需死亡事件的35%;在伊沙佐米治疗方案中有81例死亡事件,在安慰剂治疗方案中有90例死亡事件。2个治疗方案均未达到中位总生存期。在ITT人群中,本次分析估计的伊沙佐米治疗方案组中位PFS是20个月,安慰剂治疗方案组是15.9个月(HR=0.82 [95% CI(0.67, 1.0)])。
在中国(N = 115),采用相似的研究设计和入排标准,进行了一项随机,双盲,安慰剂对照的Ⅲ期研究。入组研究的许多患者在初次诊断时为晚期疾病,Duria-Salmon分期为III期(69%),并且有60%的患者接受过至少2线既往治疗,63%的患者沙利度胺耐药。在主要分析(中位随访8个月和中位治疗6个周期)中,伊沙佐米治疗方案组中位PFS为6.7个月,安慰剂治疗方案组为4个月(p值= 0.035,HR = 0.60)。 对于中位随访19.8个月的OS最终分析中, 中位OS得到了10个月的改善(伊沙佐米治疗方案组患者的中位OS为25.8个月,安慰剂治疗方案组患者的中位OS为15.8个月[p值= 0.0014,HR = 0.42,95%CI:0.242,0.726])。
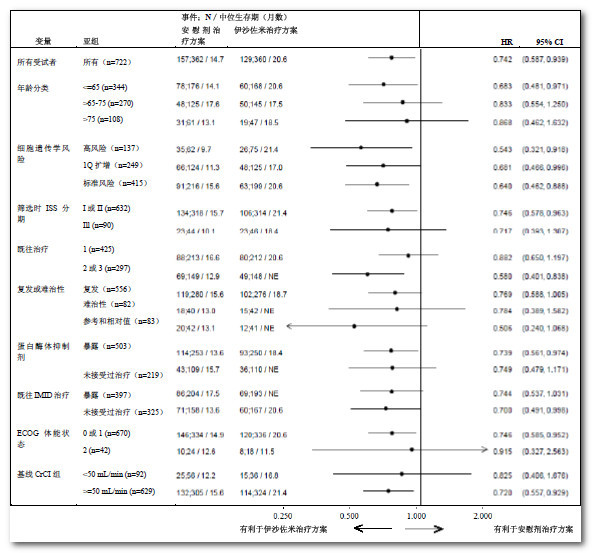
由于多发性骨髓瘤是一种异质性疾病,因此在III期研究(C16010)中,患者亚组之间的治疗获益可能会有差异(见图2)。
图2:亚组中无进展生存期的森林图
在III期研究(C16010)中,10例患者(每治疗方案组各5例)在基线存在重度肾损害。在伊沙佐米治疗方案组的5例患者中,1例患者达到经确认的部分缓解,3例达到经确认的疾病稳定(但是2例是未确认的部分缓解,1例是未确认的非常好的部分缓解)。在安慰剂治疗方案组的5例患者中,2例达到经确认的非常好的部分缓解。
在III期研究(C16010)中,通过总体健康评分(EORTC QLQ-C30和MY-20)评估的患者生活质量在治疗期间保持不变并且在两个治疗方案中相似。
【药理毒理】
药理作用
伊沙佐米是一种可逆性蛋白酶体抑制剂,可优先结合20S蛋白酶体的β5亚基并抑制其糜蛋白酶样活性。伊沙佐米在体外可诱导多发性骨髓瘤细胞系凋亡,对经硼替佐米、来那度胺和地塞米松等多种药物治疗后复发患者的骨髓瘤细胞具有细胞毒作用,伊沙佐米和来那度胺合用对多发性骨髓瘤细胞系具有协同细胞毒作用。伊沙佐米在小鼠多发性骨髓瘤异种移植模型中具有体内抗肿瘤活性。
毒理研究
遗传毒性
伊沙佐米Ames试验、小鼠体内胃和肝的彗星试验、小鼠骨髓微核试验结果均为阴性,人外周血淋巴细胞染色体畸变试验结果为阳性。
生殖毒性
未对伊沙佐米进行生育力和早期胚胎发育研究以及围产期毒性研究,但在一般毒理学研究中对生殖系统进行了评价。在大鼠长达6个月的试验和犬长达9个月的试验中,伊沙佐米对雄性和雌性生殖器官未产生明显影响。
在兔胚胎-胎仔发育毒性试验中,伊沙佐米在母体毒性剂量(≥0.3mg/kg,暴露量为临床推荐剂量4mg/kg平均暴露量的1.9倍)下,可见骨骼异常/畸形(尾椎融合、腰椎数目异常、多肋)发生率增加。在大鼠胚胎-胎仔发育毒性探索研究中,伊沙佐米在母体毒性剂量下,可见胎仔体重减轻,胎仔生存率呈降低趋势;在0.6mg/kg(暴露量为临床推荐剂量4mg/kg平均暴露量的2.5倍)剂量下,可见胚胎着床后丢失增加。在大鼠和兔胚胎-胎仔发育毒性试验中,伊沙佐米在低于母体毒性剂量时均未见直接的胚胎-胎仔毒性。
致癌性
尚未进行致癌性研究。
【药代动力学】
吸收
口服给药后约1小时,伊沙佐米血浆浓度达到峰值。平均绝对口服生物利用度为58%。在剂量范围为0.2-10.6 mg时,伊沙佐米 AUC以与剂量成比例的方式增加。
与空腹过夜后给药相比,伴高脂饮食使伊沙佐米 AUC减少了28%(见【用法用量】)。
分布
伊沙佐米有99%与血浆蛋白结合并分布到红细胞中,血液和血浆中的AUC比值为10。稳态分布容积为543L。
生物转化
在一个放射性标记剂量口服给药后,伊沙佐米占血浆中所有药物相关物质的70%。预计经多种CYP酶代谢和非CYP蛋白代谢均为伊沙佐米的主要清除机制。在临床相关的伊沙佐米浓度下,在使用人cDNA表达的细胞色素P450同工酶的体外研究中显示,无特异性CYP同工酶对伊沙佐米代谢起主要作用,非CYP蛋白促进整体代谢。当浓度超过临床观察到的浓度时,伊沙佐米经多种CYP亚型代谢,估计其相对贡献分别为3A4(42.3%)、1A2(26.1%)、2B6(16.0%)、2C8(6.0%)、2D6(4.8%)、2C19(4.8%)和2C9(<1%)。
消除
伊沙佐米呈现出多相消除曲线。根据一项群体PK分析,全身清除率(CL)约为1.86L/hr,个体间差异为44%。伊沙佐米的终末半衰期(t1/2)为9.5天。每周口服给药,第15天观察到AUC的蓄积达到大约2倍。
排泄
在5例晚期癌症患者中,C-伊沙佐米单次口服给药后,经尿排泄的放射性成分占62%,经粪便排泄占22%。尿液中回收的伊沙佐米原型药物占给药剂量<3.5%。
特殊人群
肝损害
根据群体PK分析结果,肝功能正常患者与轻度肝损害患者(总胆红素≤ULN且AST>ULN或总胆红素>1-1.5×ULN且AST为任意值)的伊沙佐米的PK相似。
在肝功能正常患者中使用剂量为4 mg(N=12)、中度肝损害患者中使用剂量为2.3 mg(总胆红素>1.5-3×ULN,N=13)或重度肝损害患者中使用剂量为1.5mg(总胆红素>3×ULN,N=18)时,确定了伊沙佐米的PK特征。与肝功能正常的患者相比,中度或重度肝损害患者的非结合的剂量标准化AUC要高27%(见【用法用量】)。
肾损害
根据群体PK分析结果,肾功能正常患者与轻度或中度肾损害患者(肌酐清除率≥30mL/min)的伊沙佐米的PK相似。
在肾功能正常患者(肌酐清除率≥90mL/min,N=18),重度肾损害(肌酐清除率<30mL/min,N=14)或需要透析的ESRD患者(N=6)中使用剂量为3mg时,确定了伊沙佐米的PK特征。与肾功能正常的患者相比,重度肾损害或需要透析的ESRD患者的非结合AUC高38%。测定透析者在血液透析前后的伊沙佐米浓度发现在透析期间两个浓度相似,表明伊沙佐米不会被透析清除(见【用法用量】)。
年龄、性别、人种
根据群体PK分析结果,年龄(23-91岁)、性别、体表面积(1.2-2.7m)或人种对伊沙佐米的清除无临床显著性影响。在亚裔患者中,平均AUC高35%;但是,白人与亚裔患者的伊沙佐米 AUC有重叠。
【贮藏】
请勿冷冻,在2~30°C保存。为了防止受潮,请置于原包装中保存。
【包装】
聚氯乙烯-铝/铝包装,1粒/板,3板/盒。
【有效期】
36个月
【执行标准】
进口药品注册标准JX20170225
进口药品注册证号2.3mg:H20180012 3mg:H20180011 4mg:H20180010
【生产企业】
公司名称:Takeda Pharma A/S
国内联系机构
名称:武田药品(中国)有限公司
信息来源:百度百科