【用法用量】
本品须在有肿瘤治疗经验医生的指导下用药。帕博利珠单抗通过静脉输注给药,每次持续至少30分钟。
用于治疗非小细胞肺癌、食管癌、头颈部鳞状细胞癌和MSI-H或dMMR结直肠癌时的患者选择
对于以下患者,应根据其PD-L1阳性表达状态,选择使用帕博利珠单抗单药治疗:
一线局部晚期或转移性非小细胞肺癌,PD-L1表达由国家药品监督管理局批准的检测方法评估。
二线局部晚期或转移性食管鳞状细胞癌,PD-L1表达需经充分验证的检测方法评估。
一线转移性或不可切除的复发性头颈部鳞状细胞癌,PD-L1表达需经充分验证的检测方法评估。
对于一线不可切除或转移性结直肠癌,应根据其MSI-H或dMMR状态,选择使用帕博利珠单抗单药治疗。MSI-H或dMMR状态需经验证的检测方法评估。
推荐剂量
帕博利珠单抗用于成人的推荐剂量为:
·200 mg每3周一次,或400 mg每6周一次
帕博利珠单抗联合化疗给药时,应首先给予帕博利珠单抗。另请参见化疗药物联合给药的处方信息。
患者应使用帕博利珠单抗治疗至疾病进展或发生不可接受的毒性。
已观察到接受帕博利珠单抗治疗肿瘤的非典型反应(例如,治疗最初几个月内肿瘤出现暂时增大或出现新的小病灶,随后肿瘤缩小)。
在对KEYNOTE-001中黑色素瘤患者的回顾性分析中,7%的患者发生假性进展,其中大部分(>60%)患者发生在治疗的前3个月内。
如果患者临床症状稳定,即使有疾病进展的初步证据,但基于总体临床获益的判断,可考虑继续应用本品治疗,直至证实疾病进展。
根据个体患者的安全性和耐受性,可能需要暂停给药或停药。不建议增加或减少剂量。有关永久停药或暂停给药的指南,请见表1所述。有关免疫相关性不良反应管理的详细指南,请参见【注意事项】
表1推荐的帕博利珠单抗治疗调整方案
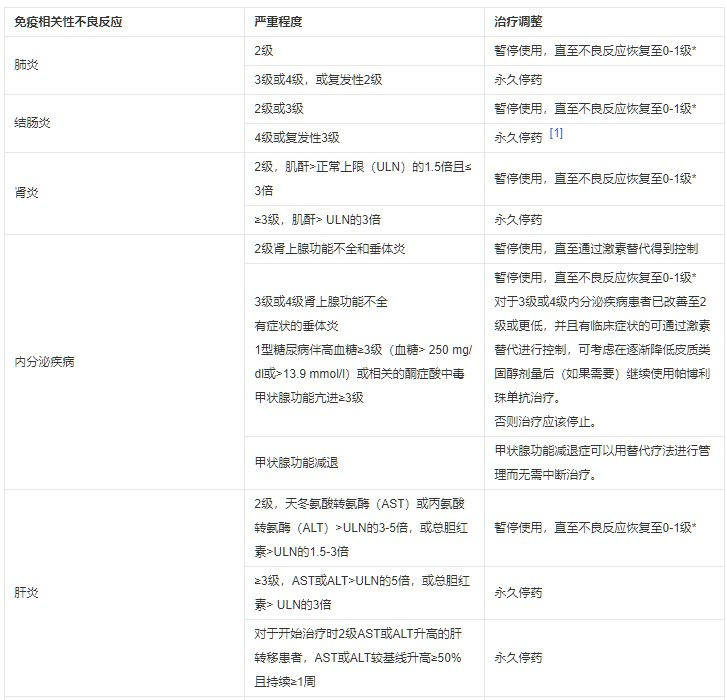
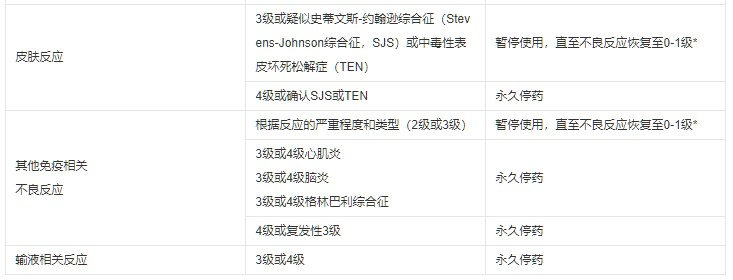
注:毒性等级依据国家癌症研究所不良事件通用术语标准4.0版(NCI-CTCAE v.4)。
如果在给予最后一剂帕博利珠单抗后12周内治疗相关毒性未恢复到0-1级,或在12周内皮质类固醇剂量不能降至每天≤10 mg泼尼松或等效药物,则帕博利珠单抗应永久停药。
既往出现过免疫相关性心肌炎的患者重新开始帕博利珠单抗治疗的安全性尚不明确,建议发生3级或4级免疫相关心肌炎的患者永久停止帕博利珠单抗治疗。
除非表1中另有规定,帕博利珠单抗作为单药或联合治疗使用时,对于4级或复发性3级的免疫相关不良反应,应永久停药。
特殊人群
儿童人群
帕博利珠单抗在儿童人群(<18岁)中的安全性和有效性尚不明确。无相关数据。
老年人群
老年(≥65岁)与年轻患者(<65岁)在安全性或有效性上未出现总体的差异。无需在这一人群中进行剂量调整。
肾功能不全
轻度或中度肾功能不全患者无需剂量调整。帕博利珠单抗尚未在重度肾功能不全患者中进行研究(参见【注意事项】和【药代动力学】)。
肝功能不全
轻度肝功能受损患者无需剂量调整。帕博利珠单抗尚未在中度或重度肝功能不全患者中进行研究(参见【注意事项】和【药代动力学】)。
给药方法
帕博利珠单抗必须通过静脉输注30分钟以上。帕博利珠单抗不得通过静脉推注或单次快速静脉注射给药。给药前药品的稀释指导如下:
溶液制备和输液
请勿摇晃药瓶。
使用前将药瓶恢复至室温(25℃或以下)。
稀释前,药瓶可从冰箱取出(温度在25℃或以下)最长放置24小时。
给药前应目测注射用药是否存在悬浮颗粒和变色的情况。浓缩液是一种无色至轻微乳白色、无色至微黄色溶液。如果观察到可见颗粒,应丢弃药瓶。
抽取所需体积最多4 ml(100 mg)浓缩液,转移到含有9 mg/ml(0.9%)氯化钠或50 mg/ml(5%)葡萄糖的静脉输液袋中,制备最终浓度范围为1至10 mg/ml的稀释液。每个小瓶过量灌装0.25ml(每个小瓶的总内容物为4.25ml),以确保能回收4 ml浓缩液。将稀释液轻轻翻转混匀。
从微生物学的角度,本品一经稀释必须立即使用。不得冷冻。稀释溶液如不能立即使用,在2-8℃条件下,理化稳定性为24小时。该24小时包括室温下(25℃或以下)最长保存6小时。冷藏后,药瓶和/或静脉输液袋必须在使用前恢复至室温。使用内置或外加一个无菌、无热原、低蛋白结合的0.2~5 μm过滤器的输液管线进行静脉输注,输液时间应大于30分钟。
请勿使用同一输液管与其他药物同时给药。
帕博利珠单抗仅供一次性使用。必须丢弃药瓶中剩余的任何未使用药物。
应根据当地要求对任何未使用的医药产品或废物进行处置。
【用药禁忌】
对本说明书【成份】项下的活性成份和辅料过敏者禁用。
【注意事项】
免疫相关不良反应
接受帕博利珠单抗治疗的患者中发生过免疫相关不良反应,包括重度和死亡病例。帕博利珠单抗治疗期间发生的大多数免疫相关不良反应是可逆的,并且可通过中断帕博利珠单抗、皮质类固醇治疗和/或支持治疗来处理。帕博利珠单抗末次给药后也会发生免疫相关不良反应。免疫相关不良反应可同时发生在多个器官系统。
对于疑似免疫相关不良反应,应进行充分的评估以确定病因或排除其他病因。根据不良反应的严重程度,应暂时停用帕博利珠单抗,并应用皮质类固醇治疗。当免疫相关的不良反应改善至≤1级时,需至少一个月的时间逐步减少皮质类固醇的用量直至停药。基于有限的临床研究数据,发生皮质类固醇无法控制的免疫相关不良反应时可以考虑使用其他全身性免疫抑制剂。
如果不良反应恢复到≤1级,且皮质类固醇剂量已降至每天≤10 mg泼尼松或等效剂量,则可在最后一次帕博利珠单抗给药后12周内重新开始帕博利珠单抗治疗。
除了可用激素替代疗法控制的内分泌疾病外(参见【用法用量】项下剂量调整部分和【不良反应】),对于任何复发性3级免疫相关不良反应以及任何4级免疫相关不良反应,应永久停用帕博利珠单抗。
免疫相关性肺炎
接受帕博利珠单抗治疗的患者中有肺炎报告(参见【不良反应】)。应对患者肺炎的相关体征和症状进行监测。疑似肺炎的病例应采用影像学检查进行确认并排除其他可能病因。
对于≥2级肺炎患者应给予皮质类固醇治疗(初始剂量为1-2 mg/kg/天泼尼松或等效剂量,之后逐渐减少剂量)。出现2级肺炎的患者暂停使用帕博利珠单抗,出现3级、4级或复发性2级肺炎的患者应永久停用帕博利珠单抗(参见【用法用量】)。
免疫相关性结肠炎
在接受帕博利珠单抗治疗的患者中有结肠炎报告(参见【不良反应】)。应对患者结肠炎的相关体征和症状进行监测,并排除其他可能病因。对于≥2级结肠炎给予皮质类固醇(初始剂量为1-2 mg/kg/天泼尼松或等效剂量,之后逐渐减少剂量),发生2级或3级结肠炎的患者应暂停使用帕博利珠单抗,发生4级或复发性3级结肠炎的患者应永久停用帕博利珠单抗(参见【用法用量】)。应考虑胃肠穿孔的潜在风险。
免疫相关性肝炎
在接受帕博利珠单抗治疗的患者中有肝炎报告(参见【不良反应】)。应监测患者的肝功能变化[治疗开始时、治疗期间(定期)以及基于临床评估具有指征时]和肝炎症状,排除其它病因。给予皮质类固醇治疗[初始剂量为0.5-1 mg/kg/天(针对2级肝炎)和1-2 mg/kg/天(针对≥3级肝炎)泼尼松或等效剂量,之后逐渐减少剂量],并根据肝酶升高的严重程度决定是暂时停药还是永久停药(参见【用法用量】)。
免疫相关性肾炎
在接受帕博利珠单抗治疗的患者中有肾炎报告(参见【不良反应】)。应监测患者的肾功能变化,排除肾功能损伤的其他病因。对于≥2级肾炎给予皮质类固醇(初始剂量为1-2 mg/kg/天泼尼松或等效剂量,之后逐渐减少剂量)。根据肌酐升高的严重程度,2级肾炎患者应暂停使用帕博利珠单抗,3级或4级肾炎患者应永久停用帕博利珠单抗(参见【用法用量】)。
免疫相关性内分泌疾病
帕博利珠单抗治疗过程中观察到重度内分泌疾病,包括肾上腺功能不全、垂体炎、1型糖尿病、糖尿病酮症酸中毒、甲状腺功能减退症和甲状腺功能亢进。
发生免疫相关内分泌疾病时,可能需要长期使用激素替代治疗。
已在接受帕博利珠单抗的患者中报告了肾上腺功能不全(原发性和继发性)。接受帕博利珠单抗治疗的患者也报告了垂体炎(参见【不良反应】)。应监测肾上腺功能不全和垂体炎(包括垂体功能低下)患者的体征和症状,并排除其他病因。根据临床指征给予皮质类固醇和其他激素替代疗法治疗肾上腺功能不全。2级肾上腺功能不全或垂体炎应暂停使用帕博利珠单抗,直到经激素替代治疗后病情得到控制。3级或4级肾上腺功能不全或症状性垂体炎应该暂停或停止使用帕博利珠单抗。如果需要,可考虑在逐渐降低皮质类固醇剂量后继续使用帕博利珠单抗(参见【用法用量】)。应继续监测垂体功能和激素水平,以确保采用适当的激素替代治疗。
接受帕博利珠单抗治疗的患者报告了1型糖尿病,包括糖尿病酮症酸中毒(参见【不良反应】)。应对患者的高血糖或其他糖尿病体征和症状进行监测。1型糖尿病患者应给予胰岛素治疗,对于等级≥3的高血糖或酮酸中毒的1型糖尿病患者应暂停使用帕博利珠单抗,直到病情得到控制为止(参见【用法用量】)。
接受帕博利珠单抗治疗的患者报告了甲状腺功能紊乱,包括甲状腺功能亢进、甲状腺功能减退和甲状腺炎,可在治疗过程中的任何时间发生。先前接受放射治疗的HNSCC患者中甲状腺机能减退更为常见。应监测患者甲状腺功能的变化[治疗开始时、治疗期间(定期)以及基于临床评估具有指征时]及甲状腺疾病的临床体征和症状。甲状腺功能减退可以使用激素替代治疗,无需中断帕博利珠单抗治疗或使用皮质类固醇。可以对症处理甲状腺功能亢进。发生≥3级甲状腺功能亢进时应停用帕博利珠单抗,直至恢复至≤1级甲状腺功能亢进。应监测甲状腺功能和激素水平,以保证适当激素替代治疗。
对于3级或4级内分泌疾病改善至2级或更低,并且可通过激素替代进行控制的患者,如果需要,可考虑在皮质类固醇剂量降低后继续使用帕博利珠单抗。否则应该永久停药(参见【用法用量】和【不良反应】)。
免疫相关性皮肤不良反应
在接受帕博利珠单抗治疗的患者中有免疫相关重度皮肤不良反应报告(参见【不良反应】)。应监测患者的重度皮肤不良反应,并应排除其他病因。根据不良反应的严重程度,对于3级皮肤反应,应暂停使用帕博利珠单抗直至其恢复到≤1级,对于4级皮肤反应,应永久停用帕博利珠单抗,并应给予皮质类固醇(参见【用法用量】)。
接受帕博利珠单抗治疗的患者中报告了SJS或TEN(参见【不良反应】)。对于疑似的SJS或TEN,应暂停使用帕博利珠单抗,并将患者转诊给专科机构进行评估和治疗。如果患者确诊SJS或TEN,应永久停用帕博利珠单抗(参见【用法用量】)。
对于既往使用其他免疫刺激性抗癌药治疗时发生过严重或危及生命的皮肤不良反应的患者,应谨慎考虑使用帕博利珠单抗。
其他免疫相关性不良反应
在临床试验或上市后使用中报告了以下其他有临床意义的免疫相关不良反应:葡萄膜炎、关节炎、肌炎、心肌炎、胰腺炎、格林巴利(Guillain-Barré)综合征、肌无力综合征、溶血性贫血、结节病、脑炎、脊髓炎和血管炎(参见【用法用量】和【不良反应】)。
应根据不良反应的严重程度及类型,2级或3级事件应暂停使用帕博利珠单抗,并给予皮质类固醇治疗。
如果不良反应恢复至≤1级,并且皮质类固醇剂量已降至每天≤10 mg泼尼松或相当剂量,则可以在最后一剂帕博利珠单抗给药后12周内重新开始帕博利珠单抗治疗。
对于任何复发性3级免疫相关不良反应以及任何4级免疫相关不良反应,必须永久停用帕博利珠单抗治疗。
对于3级或4级心肌炎,脑炎或格林巴利综合征应该永久停用帕博利珠单抗治疗(参见【用法用量】和【不良反应】)。
移植相关的不良反应
实体器官移植排斥反应
在上市后接受PD-1抑制剂治疗的患者中有实体器官移植排斥反应报告。帕博利珠单抗治疗可能会增加实体器官移植排斥的风险。在这些患者中应权衡帕博利珠单抗治疗的获益与可能的器官排斥风险。
异基因造血干细胞移植(HSCT)的并发症
异基因HSCT后使用帕博利珠单抗治疗
在既往接受过异基因HSCT的患者中,在使用帕博利珠单抗治疗后有发生急性移植物抗宿主病(GVHD),包括致命性GVHD的报道。移植手术后出现GVHD的患者,在使用帕博利珠单抗治疗后可能会增加GVHD风险。对于进行过异基因HSCT的患者,应考虑帕博利珠单抗治疗的获益与可能的GVHD风险。
多发性骨髓瘤
对于多发性骨髓瘤患者,在沙利度胺类似物和地塞米松的基础上加用帕博利珠单抗治疗后,死亡率增加。
在多发性骨髓瘤患者的两项随机临床试验中,在沙利度胺类似物加地塞米松的基础上加用帕博利珠单抗后(帕博利珠单抗不适用于这一用法),导致死亡率增加。须避免使用帕博利珠单抗联合沙利度胺类似物和地塞米松治疗多发性骨髓瘤患者。
输液相关反应
在接受帕博利珠单抗治疗的患者中有重度的输液相关反应报告,包括超敏和过敏反应(参见【不良反应】)。对于3级或4级输液反应,必须停止输液并永久停用帕博利珠单抗(参见【用法用量】)。对于1级或2级输液反应的患者在密切监测下可继续接受帕博利珠单抗治疗;可考虑用解热镇痛类抗炎药和抗组胺药预防。
疾病特异性预防措施
使用帕博利珠单抗一线治疗NSCLC患者
一般而言,帕博利珠单抗联合治疗观察到的不良反应频率高于帕博利珠单抗单药治疗或单独化疗,反映了联合治疗中这些药物各自的作用(参见【用法用量】和【不良反应】)。尚无法直接进行帕博利珠单抗联合化疗与帕博利珠单抗单药治疗的比较。
在对先前未经治疗的肿瘤表达PD�L1的NSCLC患者进行治疗之前,医生应考虑可用治疗方案(帕博利珠单抗单药或帕博利珠单抗联合化疗治疗)的获益/风险平衡。来自≥75岁患者的有效性和安全性数据有限。对于≥75岁患者,在仔细评估个体潜在的获益/风险后,应谨慎使用帕博利珠单抗联合治疗(参见【临床试验】)。
临床试验排除的患者
患有以下病症的患者被排除在临床试验之外:活动性中枢神经系统转移;ECOG PS≥2(尿路上皮癌和肾细胞癌除外);HIV感染,乙型肝炎或丙型肝炎感染;活动性全身性自身免疫疾病;间质性肺病;既往需要全身皮质类固醇治疗的肺炎;对另一种单克隆抗体有严重过敏史;正在接受免疫抑制治疗以及具有使用Ipilimumab治疗的重度免疫相关不良反应(定义为任何4级毒性或需要12周以上皮质类固醇治疗[>10 mg/天泼尼松或等效药物]的3级毒性)史。患有活动性感染的患者被排除在临床试验之外,并且需要在接受帕博利珠单抗治疗前进行感染治疗。若帕博利珠单抗治疗期间发生活动性感染,可通过适当的药物对患者进行治疗。基线时肾脏(肌酐>1.5×ULN)或肝脏(胆红素>1.5×ULN,ALT、AST>2.5×ULN,无肝转移)临床显著异常的患者也被排除出临床试验,因此,在重度肾功能不全和中度至重度肝功能不全患者中信息有限。
关于帕博利珠单抗治疗眼黑色素瘤的安全性和有效性的数据有限(参见【临床试验】)。
在仔细考虑潜在增加的风险后,可以对这些患者使用帕博利珠单抗治疗,但需要进行必要的医疗管理。
胚胎毒性
基于其作用机理,在妊娠期间使用本品可能会对胎儿造成伤害。动物模型通过诱导母体对胎儿组织的免疫耐受将PD-1/PD-L1信号传导途径与维持妊娠联系起来。如果在妊娠期间应用了这一药物,应向患者告知对胎儿的潜在危害。建议育龄女性在帕博利珠单抗治疗期间采用高效避孕方法,并在最后一次帕博利珠单抗用药后4个月内持续避孕。
配伍禁忌
在没有进行配伍性研究的情况下,本品不得与其他医药产品混合。本品不应与其它医药产品经相同的静脉通道合并输注。
对驾驶和操作机器能力的影响
帕博利珠单抗对驾驶和操作机器的能力有轻微影响。有帕博利珠单抗给药后出现眩晕和疲劳的报告(参见【不良反应】)