格列卫(格列卫)一般指甲磺酸伊马替尼片。
【药品类型】
处方药
【用途分类】
其他抗肿瘤药
【成份】
本品活性成份为甲磺酸伊马替尼。
【性状】
本品为深黄色至棕黄色双凸的薄膜衣片。
【适应症】
甲磺酸伊马替尼片,适应症为:用于治疗费城染色体阳性的慢性髓性白血病(Ph+CML)的慢性期、加速期或急变期;用于治疗不能切除和/或发生转移的恶性胃肠道间质肿瘤(GIST)的成人患者。
【规格】
(1)0.1g;(2)0.4g
【禁忌】
对本药活性物质或任何赋形剂成份过敏者禁用。
【药物相互作用】
可改变伊马替尼血浆浓度的药物
CYP3A4抑制剂:健康受试者同时服用单剂酮康唑(CYP3A4)抑制剂)后,伊马替尼的药物暴露量显著增加(平均最高血浆浓度(Cmax)和伊马替尼曲线下面积(AUC)可分别增加26%和40%)。尚无与其它CYP3A4抑制剂(如:伊曲康唑、红霉素和克拉霉素)同时服用的经验。
CYP3A4诱导剂:健康志愿者服用利福平后,伊马替尼的清除增加3.8倍(90%可信区间=3.5-4.3倍),但Cmax,AUC(0-24)和AUC (0-8)分别下降54%、68%和74%。在临床研究中发现,同时给予苯妥英药物后伊马替尼萌血浆浓度降低,从而导致疗效减低。在服用酶诱导的抗癫痫药(enzyme-inducing anti-epileptic deugs,EIAEDs)如卡马西平、奥卡西平、苯妥英、磷苯妥英、苯巴比妥及去氧苯比妥,同时接受本品治疗的恶性神经胶质瘤患者中亦观察到类似的结果。与不同时服用EIAEDs相比,伊马替尼的AUC降至73%,其它CYP3A4诱导剂如地塞米松、卡他咪嗪、苯巴比妥等,可能有类似问题,因此应避免伊马替尼与CYP3A4诱导剂同时服用。在已发表的两项研究中,伊马替尼与含有St John麦汁浸膏制剂合用时可导致本品的AUC下降30-32%。
甲磺酸伊马替尼可使下列药物改变血浆浓度
伊马替尼使辛伐他丁(CYP3A4底物)的平均Cmax和AUC分别增加2倍和3.5倍。应谨记伊马替尼可增加经CYP3A4代谢的其他药物(如苯二氮革类、双氢吡啶、钙通道拮抗剂、和其它HMG-CoA还原酶抑制剂等)的血浆浓度。因此当同时服用本药和治疗窗狭窄的CYP3A4底物(如环孢素、匹莫齐特)时应谨慎。
在与抑制CYP3A4活性相似的浓度下,伊马替尼还可在体外抑制CYP2D6的活性,因此在与甲磺酸伊马替尼同时服用时,有可能增加系统对CYP2D6底物的暴露量,尽管尚未作专门研究,建议慎用。
伊马替尼在体外还可抑制CYP2C9和CYP2C19的活性,同时服用华法林后可见到凝血酶原时间延长。因此在甲磺酸伊马替尼治疗的始末或更改剂量时,若同时在用双香豆素,应短期监测凝血酶原时间。
伊马替尼400㎎剂量每天2次对CYP2D6诱导的美托洛尔代谢的抑制作用很弱,美托洛尔的Cmax和AUC大约增加23%。伊马替尼与CYP2D6诱导剂如美托洛尔合用,似乎不存在药物间相互作用的危险因素,可不必调整剂量。
体外实验表明,伊马替尼可抑制对乙酰氨基酚的 0-葡糖醛酸化。
应警告患者避免使用含有对乙酰氨基酚的非处方药和处方药(见【注意事项】)。
【临床试验】
以下均为国外研究报道。
慢性髓性白血病临床研究
对Ph+慢性髓性白血病急变期、加速期和经α-干扰素(INF)治疗失败的慢性期患者进行了三项开放、非对照性的Ⅱ期临床研究。
在一项大规模、开放、对照的Ⅲ期临床试验中,患者为新诊断的费城染色体阳性的慢性髓性白血病患者(Ph+CML)。对儿童和青少年的治疗在两项I期研究中进行。临床研究病例中,38-40%患者的年龄为≥60岁,10-12%患者的年龄为≥70岁。
新诊断的慢性期:一项Ⅲ期临床试验比较了甲磺酸伊马替尼单药治疗与干扰素α(IFN)和阿糖胞苷(Ara-C)联合治疗的疗效。治疗无效(6个月时未达到完全血液学缓解(CHR),白细胞计数增加,24个月时未达到主要细胞遗传学缓解(MCyR)),疗效丧失(完全细胞遗传学缓解或主要细胞遗传学缓解丧失)或对治疗严重不能耐受的患者可以由一个治疗组交叉至另一个治疗组。甲磺酸伊马替尼治疗组的患者接受甲磺酸伊马替尼每天400㎎剂量。干扰素治疗组的患者接受干扰素5MlU/m2/天皮下注射;向时合用Ara-C 20㎎/m2天皮下注射,每月1 0天。
新诊断CML实验研究中的缓解结果如下表(60个月时的数据)。
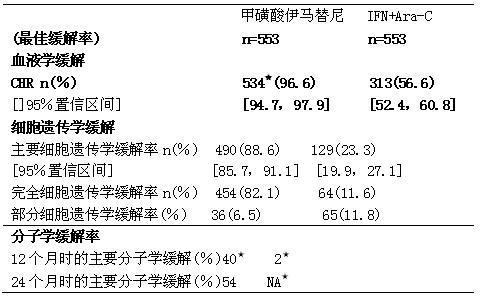
慢性髓性白血病临床研究
*p[0.001,Fisher’s exact test
**数据不全,样本中仅2例患者
60个月,甲磺酸伊马替尼组无进展生存率为83.2%,95%置信区间为(79,87);对照组为64.1%(59.69)(P[0.001)。甲磺酸伊马替尼组第一年疾病进展率为3.3%,第二年为7.5%,第3、4、5年分别为4.8%、1.5%和0.9%。
细胞遗传学的缓解程度对甲磺酸伊马替尼组患者的长期预后有重要影响。治疗1 2个月时达完全细胞遗传学缓解和部分细胞遗传学缓解患者中,分别有97%和93%的患者在第60个月时仍未进展到加速期或急变期;而治疗12个月时未达到主要细胞遗传学缓解的患者中.只有81%在第60个月时没有进展到晚期CML(总体比较p[0.001;完全细胞遗传学缓解和部分细胞遗传学缓解之间的p=0.20)。以1 8个月的缓解情况为评估时间点,达完全细胞遗传学缓解、部分细胞遗传学缓解和未达主要细胞遗传学缓解的患者在60个月时的未进展率分别为99%、90%.和83%,完全细胞遗传学缓解和部分细胞遗传学缓解在长期预后上显示出统计学差异(p[0.001)。
分子学监测可以提供更多的预后信息。治疗12个月时达完全细胞遗传学缓解且Bcr-Ab1转录水平下降至少31og的患者在60个月时保持无进展生存的可能性明显高于只达到完全细胞遗传学缓解而Bcr-Ab1转录水平下降程度小于3 109者(95% vs 89%,p=0.068),更高于12个月时未达到莞全细胞遗传学缓解者(70%,p[0.001)。如果只考虑进展到加速期/急变期的可能性,则上述三类患者的无进展生存率分别为100%、95%和88%((总体比较,p[0.001;CCyR伴MM与CCyR不伴MMR比较,p=0.007)。以18个月时的缓解情况为评估时间点,达完全细胞遗传学缓解伴主要分子学缓解的患者,60个月时未进展到加速期/急变期的几率为100%,达完全细胞遗传学缓解不伴分子学缓解者为98%,而未达完全细胞遗传学缓解者只为87%(总体比较p<0.001;CCyR伴MMR与CCyR不伴MMR比较,p=0.105)。
采用经验证的FACT-BRM问卷评价生活质量,甲磺酸伊马替尼组所有方面的评分均高于IFN-Ara-C组,生活质量数据表明,接受甲磺酸伊马替尼治疗的患者能够保持心情愉快。
α-干扰素治疗失败的慢性期患者:(532例,起始剂量400㎎,每日一次)65%的患者获得了主要细胞遗传学反应,53%获得了完全缓解,95%获得了完全血液学反应。
加速期:(235例,其中63%患者在加速期已接受过其他治疗,235例患者中77例接受伊马替尼400㎎,每日一次; 158例接受600㎎,每日一次)。结果71.5%患者获得确切的血液学反应,42%患者获得完全血液学反应,28%患者获得主要细胞遗传学反应(即分裂中费城染色体阳性细胞减少到[35%),20%获得完全细胞遗传学缓解。以血液学缓解为主要终点的分析,发现400㎎和600㎎剂量组之间无明显差异,但600㎎剂量组的细胞遗传学反应改善更明显,其持续时间更长。本研究中,600㎎剂量组的至疾病进展时间明显不同。
急变期:(260例患者,其中95例[37%]在进入加速期或急变期前均已接受过化疗,另165例[63%]此前未接受过化疗。223例开始治疗的剂量为600㎎,每日一次)。以不同的完全血液学反应作为主要疗效进行统计,31%的患者获得了肯定的血液学反应(未接受过治疗的患者为36%,接受过治疗的患者为22%),15%的患者观察到主要细胞遗传学反应。在600㎎/天患者的血液学反应比400㎎/天的患者高(分别为33%和16%,p=0.0220)。未接受和接受过治疗的患者的中位生存时间分别为7.7和4.7个月。
儿科患者:一个开放、多中心、单药治疗的Ⅱ期临床试验中,51例新诊断的未经治疗的儿科慢性期CML患者入组。甲磺酸伊马替尼治疗剂量为340mg/m[sup]2[/sup]/天,未出现剂量限制性毒性反应,无患者中断治疗。甲磺酸伊马替尼治疗后患者病情迅速缓解,8周后78%的患者获得了CHR,其中65%的患者获得完全细胞遗传学缓解(CCyR),比例高于成人患者。81%的患者获得MCy-R,其中16%获得部分细胞遗传学缓解(PCyR)。大部分获得CCyR的患者是在第3个月到第10个月之间获得CCyR的,Kaplan- Meier分析显示这些患者获得缓解的中位时问为5.6个月。
有8名患儿 (3名CML,4名急性白血病)进行另一项I期试验,3人接受的剂量为173-200㎎/m[sup]2[/sup]/天,4人接受剂量约为260㎎/m[sup]2[/sup]/天,1人接受360㎎/m[sup]2[/sup]/天的剂量。3名CML患儿中有两人获得完全细胞遗传学反应。与成人试验相比,总共39名儿童中没有特别的安全性问题。
CML慢性期(15人)或CML急变期或费城染色体阳性的急性白血病(16人)共31名儿童患者入组—项剂量逐渐增大的I期试验,这些患者既往曾接受过多次治疗,其中45%接受过骨髓移植,68%接受过多种药物化疗。患者按下列剂量接受甲磺酸伊马替尼治疗,其中260㎎/m[sup]2[/sup]/天(n=6)、340㎎/m[sup]2[/sup]/天(n=11)、440㎎/m[sup]2[/sup]/天(n=8)和570㎎/m[sup]2[/sup]/天(n=6)。在获得了细胞遗传学资料的13例CML患者中,7人(54%)获得完全细胞遗传学缓解,4人(31%)获得部分细胞遗传学缓解,相当于85%获得了主要细胞遗传学缓解。
胃肠道间质瘤(GIST)的临床研究
对不能手术切除或转移的胃肠道间质肿瘤(GIST)患者进行了一项开放、随机、多国家参加的Ⅱ期临床试验。在这项试验中,入选的147例患者随机接受口服伊马替尼400㎎或600mg治疗,每日一次,最长治疗36个月。平均治疗6—12个月(不长于36个月)。这些患者的年龄在18-83岁之间,病理诊断为C-Kit-阳性的恶性胃肠道间质肿瘤(GIST),且不能手术切除和/或为转移性。
两个剂量组人群的缓解率没有明显不同,随着治疗时间延长,很多在中期分析时疾病稳定的患者获得了部分缓解(中位随访时间31个月)。缓解的中位时间为13周(95% C.I:12-23),至缓解失败的中间时间为122周(95% C.1.:106-147),整体研究是84周(95% C.I.:71-109)。总体中位生存率数据还未完成;随访36个月时,Kaplan-Meier生存分析估计生存率为68%。达到疾病稳定和部分缓解的患者,其生存时间无统计学差异。
两个临床试验(B2222和S0033研究)中,患者接受400㎎/天或600㎎/天的起始剂量治疗,疾病进展时,剂量增加至800㎎/天。总共有103例患者的剂量增加到800㎎/天,增加剂量后,6例患者出现了部分缓解,21例患者出现了疾病稳定,总的临床获益率为26%。从目前已知的安全性资料,增加剂量到800㎎/天似乎并没有影响到甲磺酸伊马替尼的治疗安全性。
胃肠道间质瘤(GIST)辅助治疗的临床研究(Z9001)
在一项有713名患者参加的多中心、双盲、安慰剂对照、随机研究中对格列卫的辅助治疗进行了研究。患者年龄范围18-91岁。原发性GIST完全切除术后,患者随机至下列两组之一:甲磺酸伊马替尼400㎎/天或者相应的安慰剂对照组治疗1年。入组患者包括组织学诊断为经过免疫化学证实的表达KIT蛋白的原发性GIST,肿瘤最长径≥3cm,入组前14至70天行全切术的患者。
研究的有效性终点为无复发生存期(RFS),为随机日至复发日或任何原因死亡日期之间的时间。
伊马替尼显著延长了RFS,伊马替尼组患者中75%在第38个月时未发生复发,而安慰剂组为20个月(95% CIs,[30-不可估计];[14-不可估计]:(HR=0.398[0.259-0.610],p[0.0001))。伊马替尼组12个月的RFS明显优于安慰剂组,其RFS分别为97.7%和82.3%(P[0.0001)。与安慰剂组相比.在前12个月期间GIST复发的相对风险降低89%(HR=0.113;95% C1:0.049—0.264)。
根据肿瘤大小,有丝分裂数、原发肿瘤部位等对不同复发风险的原发性切除术后的GIST患者进行了回顾性分析。Z9001试验中,713例患者人群中,556名患者有有丝分裂数据。根据NIH及AFIP风险分类所进行的亚组分析如下表述。低复发风险的患者不能从该辅助治疗中得到临床获益。
按NIH和AFIP风险分类标准的Z9001试验RFS分析总结
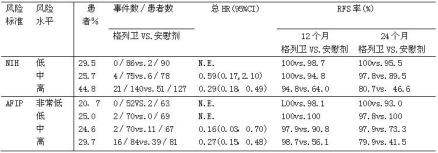
*整个随访阶段
N.E.=不可估计
HES/CEL的临床研究
在一项开放的、多中心Ⅱ期临床研究中(B2225),考察甲磺酸伊马替尼治疗与Ab1、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究包括14例嗜酸细胞过多综合征/慢性嗜酸粒细胞白血病(HES/CEL)患者,这些患者的年龄范围是16至64岁,接受甲磺酸伊马替尼每日100mg至1000mg治疗。另外在35篇已发表的病例报告中,报道了162例年龄为11至78岁的HES/CEL患者,按每日75㎎至800㎎的剂量接受甲磺酸伊马替尼治疗,血液学缓解率见下表。文献报道中患者的缓解持续时间范围是6+周至44个月。
HES/CEL的缓解率
MDS/MPD的临床研究
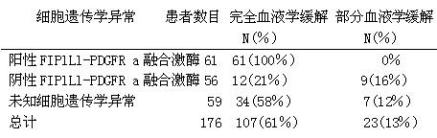
在一项开放的、多中心Ⅱ期临床研究中(B2225),考察甲磺酸伊马替尼治疗与Abl、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究包括了7例骨髓增生异常综合征/骨髓增生性疾病(MDS/MPD)患者。这些患者接受甲磺酸伊马替尼每日400mg治疗,患者的年龄范围是20至86岁。另外在12篇已发表的病例报告和一项临床研究中报道了24例MDS/MPD患者,这些患者的年龄范围为2至79岁,除3例患者接受较低剂量(100㎎/200㎎/300mg)外,其余患者接受甲磺酸伊马替尼剂量为每日400㎎。在总共31例接受治疗的MDS/MPD患者中,14例患者(45%)达到完全血液学缓解,12例患者(39%)达到主要细胞遗传学缓解(包括10例完全细胞遗传学缓解)。16例患者有染色体易位,包括染色体5q33或4q12,引起PDGFR基因重排,所有这些患者都达到血液学缓解(13例是完全缓解)。14例患者中有12例出现了细胞遗传学缓解(10患者完全缓解)。没有与PDGFR基因重排相关的易位的14例患者中,只有1(7%)例患者达到完全血液学缓解,没有1例达到主要细胞遗传学缓解。1例有PDGFR基因重排,在骨髓抑制后,分子复发的患者出现分子缓解。在Ⅱ期研究中接受治疗的7例患者的中位治疗时间是12.9个月(0.8-26.7)在已发表的文献中,有缓解的患者的中位治疗时间范围在1周至1 8个月以上,结果见下表。在Ⅱ期研究中缓解的持续时间是141+天至457+天。
MDS/MPD的缓解率
ASM的临床研究
在一项开放的、多中心Ⅱ期临床研究中(B2225),考察甲磺酸伊马替尼治疗与Ab1、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究包括5例侵袭性系统性肥大细胞增生症(ASM-)患者,这些患者接受甲磺酸伊马替尼的剂量为每日100 ㎎至400㎎,年龄范围是49至74岁。另外10篇已经发表的病例报告报道了23例年龄为26岁至85岁的ASM患者,接受甲磺酸伊马替尼每日100㎎至400㎎的治疗。
在已经发表的病例报告和在Ⅱ期研究中,对28例ASM患者中的20例进行了细胞遗传学异常的评估。20例患者中的7例有FIPlLl-PDGFRα融合激酶(或CHIC2缺失)。有这种细胞遗传学异常的患者主要是男性,并且有与系统性肥大细胞病相关的嗜酸粒细胞增多。2例患者在近膜区有Kit突变(1例Phe522Cys和1例K5091),4例患者有D816V c-Kit突变(被认为对甲磺酸伊马替尼不敏感),1例患者同时患有CML。
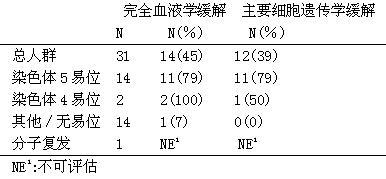
28例接受治疗的ASM患者中,8例患者(29%)达到完全血液学缓解,9例患者(32%)达到部分血液学缓解(61%的总缓解率)。在Ⅱ期研究中,5例ASM患者接受甲磺酸伊马替尼治疗的中位时间是13个月(范围是1.4-22.3个月),在已发表的医学文献中所报道的出现缓解的患者,这个中位时间在1个月至30个月以上。ASM患者对甲磺酸伊马替尼的反应率见下表。文献中患者的缓解持续时间范围是1+个月至30+个月。
ASM的缓解率
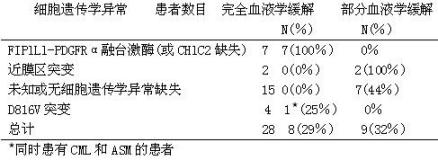
对于侵袭性小的系统性肥大细胞增多症(SM),甲磺酸伊马替尼未显示有效。所以,不建议将甲磺酸伊马替尼用于皮肤肥大细胞增生病、静止性系统性肥大细胞增多症(隐袭性SM或单纯性骨髓肥大细胞增生症),伴有相关的克隆性血液的非肥大细胞系疾病的SM、肥大细胞白血病、肥大细胞肉瘤或皮肤外肥大细胞瘤。有D816V c-Kit突变的患者对甲磺酸伊马替尼不敏感,不应该接受甲磺酸伊马替尼治疗。
DFSP的临床研究
隆突性皮肤纤维肉瘤(DFSP)是一种皮肤软组织肉瘤。它的特征是染色体17和22易位,引起α1 1型胶原基因和PDGF B基因融合。
在一项开放的、多中心Ⅱ期临床研究中(B2225),考察甲磺酸伊马替尼治疗与Abl、Kit或PDGFR蛋白酪氨酸激酶相关的、威胁生命的疾病的疗效和安全性。这项研究入组了12例初始手术切除之后局部复发且进一步手术不能带来临床收益的转移性DFSP患者。他们接受甲磺酸伊马替尼每日800mg治疗(年龄范围23至75岁)。另外在5篇已发表的病例报告中,报道了6例接受甲磺酸伊马替尼治疗的DFSP患者,年龄范围是18个月至49岁。因此.共有18例DFSP患者接受甲磺酸伊马替尼治疗,其中8例是转移性疾病。在已发表的文献中,成年患者接受甲磺酸伊马替尼治疗剂量是400㎎/日(4个病例)或是800㎎/日(1个病例)。一个儿科患者接受400㎎/m2/日,随后增加至520㎎/m2/日。10例患者有PDGF B基因重排,5例患者没有可获取的细胞遗传学数据,3例患者有复杂的细胞遗传学异常。对治疗的反应见下表。
DFSP的缓解率

这18例患者中的12例或者达到完全缓解(7例患者)或者在部分缓解之后通过手术达到无疾病生存(5例患者,包括1例儿童),使得总的完全缓解率达到67%。还有3例患者达到部分缓解,使得总缓解率达到83%。在有转移性疾病的8例患者中,5例患者出现缓解(62%),其中3例患者为完全缓解(37%)。在10例有PDGF B基因重排的患者中,4例完全缓解,6例部分缓解。在Ⅱ期研究中缓解的中位持续时间是6.2个月,最大持续时间是24.3个月,而在已发表的文献中,这种持续时间范围是4周至20月以上.
肝功能不全患者的临床研究
一项以不同程度肝功能不全患者(轻度、中度和重度)为研究对象的试验中,平均伊马替尼暴露量(标准剂量AUC)与肝功能正常的患者相比无增加。该研究中,500㎎每天一次可安全用于轻度肝功能不全患者,300㎎每天一次对其它肝功能不全患者亦是安全的。尽管在中重度肝功能不全患者中仅采用了300mg每天一次的剂量,但是药代动力学分析表明400㎎这一剂量水平同样是安全的(见【用法用量】,【注意事项】,【不良反应】,【药代动力学】)。
肾功能不全患者的临床研究
一项以不同程度肾功能不全患者(轻度、中度和重度)为研究对象的试验中,平均伊马替尼暴露量(标准剂量AUC)与肾功能正常的患者相比增加了1.5—2倍,与血浆AGP-一种与伊马替尼牢固结合的蛋白-水平的升高相符。尚未发现伊马替尼暴露量与肾功能不全的严重程度存在相关性。在本研究中,800mg每日一次可安全用于轻度肾功能不全患者,而600㎎每日一次对中度肾功能不全患者亦是安全的。由于纳入试验的患者例数有限,目前尚未在中度肾功能不全患者中进行800㎎剂量水平的研究。仅有2例严重肾功能不全的患者纳入研究并接受低剂量(100mg)治疗,未进行较高剂量的评价。研究中未纳入正在进行血液透析的患者。文献资料表明一例正接受血液透析治疗的晚期肾病患者对400㎎这一剂量的耐受性很好。该患者的PK血浆暴露量落在肾功能正常的伊马替尼及其代谢产物CGP74588的范围内,尚未发现透析影响伊马替尼的血浆动力学。由于伊马替尼几乎不经肾脏排泄,故严重肾功能不全及正接受透析治疗的患者可接受起始剂量为400 ㎎的治疗。然而,对于这些患者,仍需慎重。如果不能耐受,可减量;疗效欠佳,可增加剂量(见【用法用量】,【注意事项】,【药代动力学】)。
【药理毒理】
药理作用
伊马替尼在体内外均可在细胞水平上抑制Bcr-Ab1酪氨酸激酶,能选择性抑制Bcr-Ab1阳性细胞系细胞、费城染色体阳性(Ph+)的慢性髓性白血病(CML)和急性淋巴细胞白血病患者的新鲜细胞的增殖和诱导其凋亡。
此外,伊马替尼还可抑制血小板衍化生长因子(PDGF)受体、干细胞因子(SCF),c-Kit受体的酪氨酸激酶,从而抑制由PDGF和干细胞因子介导的细胞行为。
胃肠道间质肿瘤(GIST)细胞表达活性kit突变,体外实验显示伊马替尼抑制GIST细胞的增殖并诱导其凋亡。
有极少在临床产生耐药的报道,关于伊马替尼耐药的发生,初始耐药(从开始治疗即无效)和继发耐药的区别是在整个伊马替尼的暴露进程中显示无效,Bcr-Ab1酪氨酸激酶,在疾病进程中增加,即为产生耐药的分子机制。在治疗的患者中产生耐药发生率很低,或者是没有按照要求服药。因此,治疗应尽早开始,同时剂量应严格按要求服用。
毒理研究
在经伊马替尼长期治疗后,大鼠机会性感染的发生率增加,并且猴子体内通常被抑制的疟疾感染病情加重。
遗传毒性
在一项体外细菌(Ames test)实验、一项体外哺乳动物细胞分析(小鼠淋巴瘤实验)和一项体内大鼠微核实验中,伊马替尼均没有显示任何基因毒特性。在一项体外哺乳细胞基因碎片(clastogenicity)分析中(中国地鼠卵巢细胞染色体畸变),当代谢激活时,发现伊马替尼有阳性的基因毒作用。出现在成品中的因生产过程而产生的两个中间产物在Ames实验显示致突变性,其中一个中间产物在小鼠淋巴瘤实验中也呈阳性。
生殖毒性
一项生殖力实验中,连续70天给予雄性大鼠60㎎/kg(约相当于最大临床剂量800㎎/天),睾丸和副睾的重量减轻,同时精子的活动厦降低。狗口服剂量<30㎎/k时也观察到其精子的产生有轻度到中度降低。在一项雌性大鼠的生殖力研究中,交配和孕鼠的数量没有变化,但是在剂量60㎎/k9而不是≤20㎎/kg时,植入后胎儿的死亡明显增加,同时活胎数降低。
在一项大鼠围产期的发育研究中,口服给予45㎎/kg/天,死胎的数量和出生后第0天到第4天之间.死亡的数量增加。F1代仔鼠给予同样的剂量,从出生到终点解剖,平均体重降低。F1代的生殖力没有受到影响,但注意到45mg/kg/天剂量组吸收的数量增加,同时能够生育的胎儿的数量降低。母代动物给予45㎎/kg/天,F1代给予15㎎/kg/天(临床最大剂量800㎎的1/4),是没有毒性作用的剂量水平。
在器官形成期给予大鼠伊马替尼≥100㎎/kg有致畸作用,该剂量约相当于临床最大剂量800㎎/天的1.5倍。致畸作用包括露脑和脑膨出,以及缺失/缺损额骨和/或缺失顶骨。在≤30㎎/kg组没有观察到上述作用。
致癌性
在为期2年的大鼠致癌性研究中,伊马替尼给药方案为15、30和60㎎/kg/天,结果60㎎/kg/天组的雄性大鼠和≥30㎎/kg/天组的雌性大鼠的寿命显著缩短,显示有明显统计学意义。死亡大鼠的组织病理学结果表明心肌病(雄性和雌性)、慢性进展性肾病(雌性)和包皮腺乳头状瘤是主要的死因。出现肿瘤变化的靶器官有肾脏、膀胱、尿道、包皮腺和阴蒂腺、小肠、甲状旁腺、肾上腺和胃部无腺体区。伴有肿瘤损害的靶器官中未观察到毒性效应水平(非观测级毒性反应,no observed effect Ievels,NOEL)的剂量为:肾脏、膀胱、尿道、小肠、甲状旁腺、肾上腺和胃部无腺体区30㎎/kg/天,包皮腺和阴蒂腺15㎎/kg/天。
包皮腺/阴蒂腺的/乳头状瘤/癌瘤的发生率在30和60㎎/kg/天剂量水平时较明显,相当于人每日暴露量400㎎/天或800㎎/天剂量水平的O.5-4或0.3-2.4倍(根据AUC评价),而340㎎/m2的剂量水平则相当于儿童(根据AUC评价)每日暴露量的0.4-3.0倍。60㎎/kg/天剂量水平时,肾脏腺瘤/癌瘤、膀胱和尿道乳头状瘤、小肠腺癌、甲状旁腺腺瘤、肾上腺的良性和恶性髓质肿瘤以及无腺体胃部乳头状瘤/癌瘤易发生。
以上大鼠致癌性研究结果与人类的关联性目前不详。来自于临床试验和自发性不良事件报告的安全性数据分析尚未证明接受伊马替尼治疗的患者的恶性肿瘤发病率高于普通人群。
早期临床前试验中尚未证实心血管系统、胰腺、内分泌器官和牙齿的非肿瘤损害。在某些动物中,引起心功能不全的最重要体征包括心肌肥厚和心脏扩大。
【药代动力学】
伊马替尼的药代动力学是在25~1000㎎剂量范围,在单剂量和达稳态后评价的。
伊马替尼剂量在25~1000㎎范围内,其平均曲线下面积(AUC)的增加与剂量存在比例性关系。重复给药的药物累积量在达稳态时为1.5~2.5倍。
吸收
伊马替尼的平均绝对生物利用度为98%,口服后血浆伊马替尼AUC的变异系数波动在40~60%之间。与空腹时比较,高脂饮食后本药吸收率轻微降低(Cmax减少11%,tmax延后1.5小时),AUC略减少(7.4%)。
分布
约95%与血浆蛋白结合,绝大多数是与白蛋白结合,少部分与α-酸性糖蛋白结合,只有极少部分与脂蛋白结合。整个机体内的总体分布浓度较高,分布容积为4.9L/kg体重,但红细胞内分布比率较低。体内组织中有关药物分布情况仅来源于临床前的资料。肾上腺和性腺中摄取水平高,中枢神经系统中摄取水平低。
代谢
人体内主要循环代谢产物是N-去甲基哌嗪衍生物,在体外其药效与原药相似。该代谢物的血浆AUC是原药甲磺酸伊马替尼AUC的16%。伊马替尼是CYP3A4的底物,又是CYP3A4、CYP2D6、CYP2C9和CYP2C19的抑制剂,因此,可影响合用药物的代谢。(见【药物相互作用】)。
消除
伊马替尼的消除半衰期为18小时,其活性代谢产物半衰期为40小时,7天内约可排泄所给药物剂量的81%,其中从粪便中排泄68%,尿中排泄13%。约25%为原药(尿中5%,大便中20%),其余为代谢产物,在粪便和尿中活性代谢产物和原药的比例相似。
特殊患者群的药代动力学
成人群体药代动力学研究表明,性别对药代动力学无影响,体重的影响也可略而不计。
给予同样的剂量(400㎎/天),GlST患者其稳态时的药物暴露量是CML患者的1.5倍。依据初步的GIST患者的群体药代动力学研究,伊马替尼的药代动力学有3项指标的变化(白蛋白、WBC和胆红素)在统计学上有显著性影响。低白蛋白水平降低清除,正如较高的WBC水平。但是这些影响并不足以断定剂量需要调整。
儿童用药
儿童和青少年260㎎/m2和340㎎/m2的使用剂量会产生同样的药物暴露,分别相当于成人的400㎎和600㎎。以340㎎/m2/天的剂量经每日一次重复给药后,第8天和第1天的AUC(0-24)比揭示出有1.7倍的药物蓄积。
老年用药
据报道在一项超过65岁的患者大于20%的临床研究结果,年龄对药代动力学没有明显的影响。
器官功能不全
伊马替尼及其代谢产物几乎不通过肾脏排泄。轻中度肾功能不全患者的血浆暴露量略高于肾功能正常的患者,增加约1.5—2倍,与血浆AGP水平增加1.5倍相符,AGP可与伊马替尼牢固结合。由于伊马替尼几乎不经肾脏排泄,故肾功能不全和肾功能正常患者的伊马替尼原药清除率大概相似(见【用法用量】,【注意事项】)。
尽管药代动力学结果显示有个体差异,但与肝功能正常的患者相比,伴有不同程度肝功能不全的患者对伊马替尼的平均暴露量未见增加(见【用法用量】,【注意事项】,【不良反应】)。
【贮藏】
30℃以下保存。
【包装】
0.1g/片:PVC-铝泡罩包装,60片/盒
0.49/片:PVC/PE/PVDC-铝泡罩包装,30片/盒
【有效期】
36个月。
【执行标准】
进口药品注册标准JX20040087
信息来源:百度百科