乌帕替尼缓释片是艾伯维开发的一种选择性JAK抑制剂],2022年2月国家药品监督管理局批准,用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的成人和12岁及以上青少年的难治性、中重度特应性皮炎患者。乌帕替尼缓释片的上市,为特应性皮炎患者的治疗提供了更多选择。 [1]2022年3月国家药品监督管理局批准 ,用于治疗对一种或多种TNF抑制剂应答不佳或不耐受的中度至重度活动性类风湿关节炎成人患者和对一种或多种DMARDs疗效不佳或不耐受的活动性银屑病关节炎(PsA)成人患者。乌帕替尼缓释片成为治疗PsA首个在中国获批的靶向疗法,开启了中国PsA的靶向治疗新时代。 2023年2月20日,乌帕替尼缓释片获国家药监局批准用于治疗对一种或多种TNF抑制剂应答不佳或不耐受或禁忌的中度至重度活动性溃疡性结肠炎成人患者,成为继特应性皮炎、银屑病关节炎、类风湿关节炎后在华获批的四个适应症,也是该药物在中国胃肠病学领域首个获批的适应症。
通过阻断 JAK-STAT 信号通路中 Janus 激酶的活性起作用,JAK-STAT 信号通路是一种细胞内通路,在促炎细胞因子的释放中起主要作用,这些细胞因子刺激类风湿关节炎、银屑病关节炎和特应性皮炎的炎症。
【成分】
本品主要成分为乌帕替尼。
【规格】
按C17H19F3N6O计(1)15mg (2)30mg
【适应症】
1.类风湿性关节炎
乌帕替尼适用于对一种或多种TNF阻滞剂反应不足或不耐受的中度至重度活动性类风湿关节炎成人患者。
2.银屑病性关节炎
乌帕替尼适用于对一种或多种TNF阻滞剂反应不足或不耐受的活动性银屑病关节炎成年患者。
3.特应性皮炎
乌帕替尼适用于患有难治性中、重度特应性皮炎的成人和12岁及以上儿科患者,这些患者的疾病不能通过其他系统性药物(包括生物制剂)得到充分控制,或者不适宜使用这些疗法。
4. 溃疡性结肠炎
乌帕替尼适用于对一种或多种TNF阻滞剂反应不足或不耐受的中度至重度活动性溃疡性结肠炎成年患者
【药理作用】
乌帕替尼是一种Janus激酶(JAK)抑制剂。JAK是细胞内酶,可传递细胞膜上的细胞因子或生成因子受体相互作用产生的信号,从而影响血细胞生成的细胞过程和免疫细胞功能。在此信号转导通路中,JAK磷酸化并激活信号转导与转录活化因子(STAT),STAT调节细胞内基因表达等活动。乌帕替尼在JAK位点调节此信号传导通路,阻滞STAT的磷酸化和活化。 [4]
JAK酶通过自身的配对(如JAK1/JAK2、JAK1/JAK3、JAK1/TYK2、JAK2/JAK2、JAK2/TYK2)传递细胞因子信号。在不含细胞的分离酶活性测定中,乌帕替尼对JAK1和JAK2的抑制作用高于对JAK3和TYK2的抑制作用。在人白细胞中开展的细胞测定中,乌帕替尼对JAK1和JAK1/JAK3介导的细胞因子诱导的STAT磷酸化的抑制作用比对JAK2/JAK2介导的STAT磷酸化的抑制作用更强。但是,目前尚不清楚这种特异性JAK酶抑制作用与治疗效果的相关性。
【临床试验】
特应性皮炎
在“头对头”III期Heads Up研究中:乌帕替尼与度普利尤单抗]相比在主要终点和全部次要终点方面均表现出疗效优势。]与度普利尤单抗 相比,乌帕替尼起效更快,患者在治疗1周内瘙痒减轻、2周后皮损清除改善、治疗16周后有更高比例的患者实现高水平的皮损清除。
Measure Up 1 和 Measure Up 2: [5]评估乌帕替尼与安慰剂相比治疗中度至重度重度患者的疗效和安全性。第 16 周,两项研究均达到了共同主要终点(所有 p<0.0001) : EASI-75 的患者比例在乌帕替尼 15 mg(281 名患者中的 196 名 [70%])和 乌帕替尼 30 mg(285 名患者中的 227 [80%])组中显着高于安慰剂组(281 名患者中的 46 名 [16%]); vIGA-AD 反应的患者比例在乌帕替尼 15 mg(135 [48%] 患者)和乌帕替尼 30 mg(177 [62%] 患者)组显着高于安慰剂组(24 [8%] 患者)。 [5]研究数据证明: 单药治疗可能是一种有效的治疗选择,并且在患有中度至重度特应性皮炎的青少年和成人中具有积极的获益-风险特征。
AD Up:评估乌帕替尼加外用糖皮质激素与安慰剂相比治疗中度至重度特应性皮炎的疗效和安全性。第 16 周,达到 EASI-75 的患者比例在乌帕替尼 15 mg 加局部外用糖皮质激素 [1]组(300 名患者中的 194 [65%] 名)和 乌帕替尼 30 mg 加局部外用糖皮质激素]组(229 [77%] 297 名患者)优于安慰剂组(304 名患者中的 80 名 [26%]; [6]vIGA-AD 反应的患者比例在乌帕替尼 15 mg 加局部外用糖皮质激素]组(119 [40%] 例患者)和乌帕替尼 30 mg 加局部外用糖皮质激素]组(174 [59%] 例患者)中显着更高) 比安慰剂组(33 名 [11%] 患者。研究数据证明:乌帕替尼加外用糖皮质激素的耐受性良好,优于安慰剂加外用糖皮质激素。乌帕替尼作为联合疗法在患有中度至重度特应性皮炎的成人和青少年中具有积极的获益-风险特征。
类风湿关节炎
M15-557:是一项在 338 例来自中国、韩国和巴西的 csDMARDs 应答不佳的中度至重度活动性类风湿关节炎患者中进行的 64 周临床研究。患者在背景csDMARDs 基础上接受每日一次本品 15mg 或安慰剂治疗。完成 12 周访视(研究第 1 阶段)的患者将进入 52 周开放标签的扩展研究(研究第 2 阶段),接受每日一次本品 15mg。
接受本品 15mg 患者与安慰剂组相比在第 12 周时 DAS28-CRP 较基线的变化(总体人群:-2.56 vs -0.95, p<0.001),显示出更大的疾病活动度的改善。
总体达到ACR20,ACR50和 ACR70 应答,以及 DAS28-CRP ≤ 3.2,DAS28- CRP < 2.6 和 CDAI≤10 的比例见表 12。
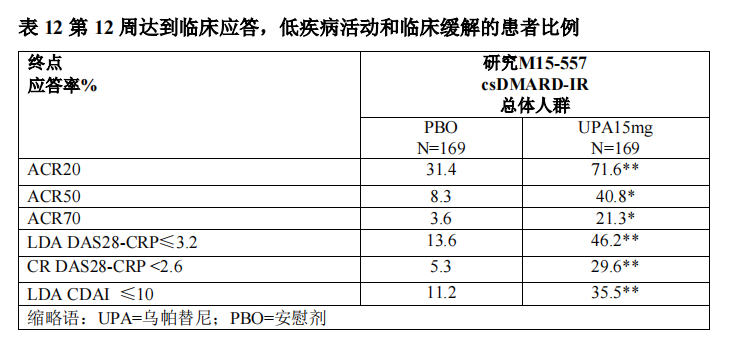
HAQ-DI 结果显示,12 周时接受本品 15mg 的治疗组相比于安慰剂组获得更显著的躯体功能改善(总体人群:-0.62 vs -0.18, p<0.001),并且患者在 PCS 评分、MCS 评分以及 SF-36 的所有 8 个领域中均得到更大的较基线的改善。在研究的前 12 周(第 1 阶段)本品 15mg 在改善疾病症状和体征方面明显优于安慰剂,与全球 csDMARD-IR 临床研究(RA-III)的疗效结果一致。
研究第 2 阶段的疗效评价指标包括 ACR20/50/70,单个 ACR 组分,DAS28- CRP, 和 CDAI。最初随机分配至本品治疗组并在第 2 阶段继续接受本品的患者在 64 周治疗期间疗效持续改善或维持。第 12 周时由安慰剂转为本品治疗的患者在转换治疗后的首次或第二次访视时,症状和体征、疾病活动、躯体功能和健康相关生活质量均有迅速改善。
中国亚组的研究结果与总体人群一致。
银屑病关节炎
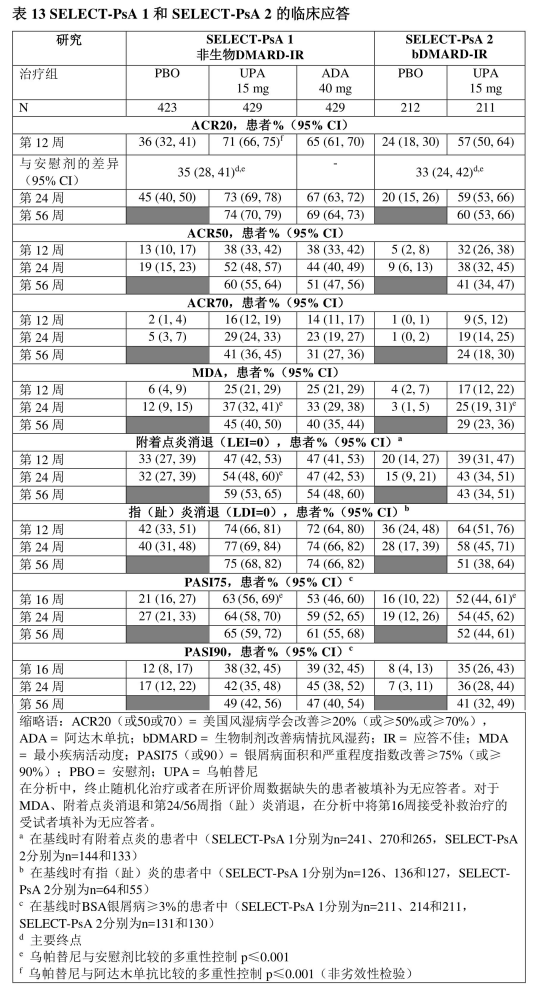
SELECT-PsA 1:是一项在1705例对至少一种非生物DMARD应答不佳或不耐受的患者中进行的24周研究。
SELECT-PsA 2:是一项在642例对至少一种生物制剂DMARD应答不佳或不耐受的患者中进行的24周研究。
研究中,接受乌帕替尼15 mg治疗的患者在第12周达到ACR20应答的比例均显著高于安慰剂组(表13)。
与安慰剂相比,乌帕替尼15 mg治疗实现ACR的各个组分改善,包括压痛/疼痛和关节肿胀计数、患者和医生总体评估、HAQ-DI、疼痛评估和hsCRP。
在SELECT-PsA 1中,在第12周达到ACR20应答的患者比例方面,乌帕替尼15 mg与阿达木单抗相比具有非劣效性。
这两项研究中,单用或与甲氨蝶呤联用时均观察到一致的应答(主要和关键次要终点)。 [17]
在所评价的各亚组中,无论基线BMI、基线hsCRP和既往非生物DMARDs使用数量(≤1或>1)如何,均证实了乌帕替尼15 mg的疗效。
溃疡性结肠炎
U-ACHIEVE和U-ACCOMPLISH:采用乌帕替尼每日一次45 mg,持续给药8周的方案;在随后的维持研究(U-ACHIEVE维持研究)中使用15 mg或30 mg,每日一次,持续至52周的给药方案。在所有的临床试验中,相比于安慰剂,在第8周和52周时接受乌帕替尼治疗达到临床缓解的患者显著更多。此外,研究还达到了所有次要终点,包括内镜改善和组织学-内镜黏膜改善(HEMI),以及维持期无激素临床缓解。与安慰剂相比,所有的主要终点和按次次要终点的p值均<0.001。
V-研究结果表明:乌帕替尼在治疗后8周的诱导期临床缓解率、临床应答率及52周的维持缓解率,均显著高于安慰剂对照组,该药的上市将为中重度溃疡性结肠炎患者的治疗提供新的选择。
【特殊人群用药】
儿童用药: [4]在12岁以下特应性皮炎儿童中的安全性和疗效尚不明确。
肾功能损害: [4]轻度或中度肾功能损害的患者无需调整剂量。有重度肾功能损害的患者,推荐剂量为15 mg每天一次。
肝功能损害: [4]轻度(Child Pugh A)或中度(Child Pugh B)肝功能损害的患者无需调整剂量。不应在重度肝功能损害(Child Pugh C)的患者中使用本品。
【获批历史】
2019年8月,乌帕替尼获批FDA批准用于治疗中重度类风湿关节炎患者。
2019年12月,乌帕替尼获得EMA批准用于治疗对一种或多种缓解疾病的抗风湿药物 (DMARD)应答不佳或不耐受的中度至重度活动性类风湿关节炎。
2021年1月,乌帕替尼获得EC批准用于治疗对一种或多种缓解疾病的抗风湿药(DMARDs)应答不佳或不耐受的活动性银屑病关节炎 (PsA)成年患者。
2021年8月,乌帕替尼获得EMA批准用于治疗适合接受系统性治疗的中度至重度特应性皮炎的成人和12岁及以上的青少年患者。
2021年12月,乌帕替尼获得美国FDA批准用于治疗对一种或多种肿瘤坏死因子 (TNF) 阻滞剂反应不足或不耐受的活动性成人银屑病关节炎患者 。
2022年1月,乌帕替尼获得美国FDA批准用于治疗成人和12岁及以上儿童难治性、中度至重度特应性皮炎。
2022年3月,乌帕替尼获得美国FDA批准用于治疗既往对一种或多种肿瘤坏死因子(TNF)抑制剂应答不足或不耐受的成年中重度活动性溃疡性结肠炎(UC)患者。
2022年04月,乌帕替尼获得美国FDA批准用于治疗对一种或多种肿瘤坏死因子(TNF)抑制剂应答不佳或不耐受的活动性强直性脊柱炎(AS)成人患者。
2022年7月,乌帕替尼获得欧盟委员会(EC)批准用于在成人中治疗对常规治疗或生物制剂反应不足、反应丧失或不耐受的中重度活动性溃疡性结肠炎。
2022年7月,乌帕替尼获得欧盟委员会(EC)批准用于用于治疗对非甾体类抗炎药(NSAID)应答不足、C反应蛋白(CRP)升高和/或磁共振成像(MRI)显示有客观炎症体征的活动性放射学阴性中轴型脊柱关节炎(nr-axSpA)成人患者。
2022年10月,乌帕替尼获得美国食品药品监督管理局(FDA)批准用于治疗对肿瘤坏死因子(TNF)抑制剂治疗疗效欠佳或不耐受并显示有客观炎症证据的活动性放射学阴性中轴型脊柱关节炎(nr-axSpA)成人患者。
【剂型】
片剂
【医保信息】
2023年1月,乌帕替尼缓释片被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2022年)》 ,覆盖特应性皮炎、类风湿关节炎和银屑病关节炎适应症 。
【研发计划】
乌帕替尼缓释片在中国治疗特应性皮炎(长期扩展研究)、银屑病关节炎(长期扩展研究)、克罗恩病、溃疡性结肠炎和中轴型脊柱关节炎 III期研究还在进行中。
【包装规格】
7片/盒;28片/盒。
【批准文号】
15mg:国药准字HJ20220010
30mg:国药准字HJ20220011
【上市许可持有人】
AbbVie Deutschland GmbH & Co. KG
信息来源:百度百科