【用途分类】
其他抗肿瘤药
【成份】
主要成份:醋酸阿比特龙
【性状】
本品为白色至类白色,椭圆形片剂。
【适应症】
本品与泼尼松合用,治疗转移性去势抵抗性前列腺癌(mCRPC)。
【规格】
250mg
【临床试验】
本品针对去势治疗失败后的mCRPC的有效性和安全性已经在2项随机、安慰剂对照、多中心III期临床试验中得到证实。这2项试验排除了既往使用过酮康唑治疗和有肾上腺或脑垂体病史的患者。
研究1 既往接受过多西他赛化疗的转移性去势抵抗性前列腺癌患者
在1项随机、安慰剂对照、多中心III期临床试验中,在既往接受多西他赛化疗的去势抵抗性前列腺癌患者中评估本品的疗效和安全性。按2:1比例随机分配共1195例患者口服本品 1000 mg每日1次联合泼尼松5 mg每日2次(N = 797)或口服安慰剂每日1次联合泼尼松5 mg每日2次(N = 398)。被随机分配到任一组的患者将持续治疗至疾病进展(定义为PSA较基线 / 最低值增加25%并伴有方案定义的影像学进展和症状或临床进展)、开始新的抗肿瘤治疗、不可耐受的毒性或退出研究。本试验排除了既往接受过酮康唑治疗前列腺癌和有肾上腺或垂体疾病史的患者。
各组间的患者人口统计学数据和基线疾病特征是均衡的。患者中位年龄为69岁(39~95岁),种族分布为:高加索人占93.3%,黑人占3.6%,亚裔1.7%,其他占1.6%。89%入组患者的ECOG体力状态评分0-1,简明疼痛量表评分≥4(在前24小时报告最痛)的患者占45%。90%患者出现骨转移,30%患者出现内脏转移。70%患者具有影像学疾病进展的证据,30%患者仅有PSA进展。70%患者既往接受一种细胞毒化疗方案,30%接受两种方案治疗。
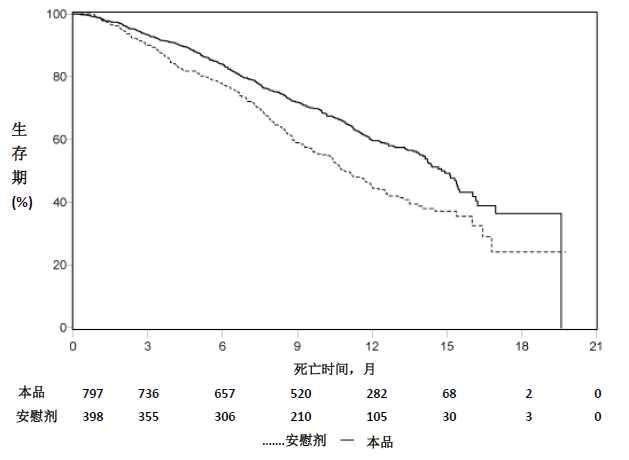
在发生552例死亡后按方案进行预定的中期分析,结果显示本品组患者的总生存期较安慰剂组有统计学显著改善(表5和图1)。在观察到775例死亡后(占最终分析计划死亡数的97%),更新生存分析。得到结果与期中分析结果一致(表6)。
表6:接受本品或安慰剂与泼尼松或泼尼松龙治疗患者(正在接受LHRH激动剂治疗或既往睾丸切除术治疗)的总生存期 (意向治疗分析集)
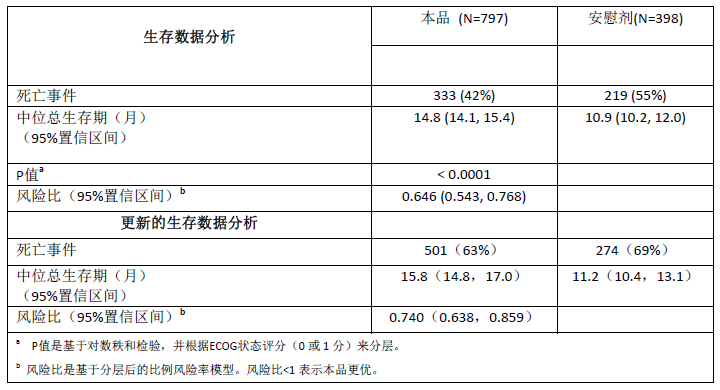
在开始治疗后数月内的所有评价时间点,本品治疗患者的生存率均高于安慰剂组(图1)。
图1 接受本品或安慰剂与泼尼松或泼尼松龙的患者(正在接受LHRH激动剂治疗或既往睾丸切除术联合治疗)的Kaplan Meier生存曲线 (意向治疗分析集)
研究2 未经化疗的转移性去势抵抗性前列腺癌患者
本研究中入组的受试者既往未接受过化疗,受试者无症状或有轻微症状,且尚无化疗临床指征。根据简明疼痛调查表(BPI-SF),过去24小时内最严重疼痛强度的评分若为0-1分,则视为无症状,若为2-3分,则视为有轻微症状。研究中排除了中度或中度疼痛、使用阿片类药物治疗癌痛或有内脏转移的受试者。
共1,088例患者按1:1比例随机分配接受口服本品1000mg每日1次(n=546)或口服安慰剂每日1次(n=542),两组均合并服用泼尼松5mg每日2次。当患者出现影像学或临床(细胞毒化疗、放疗或手术治疗、阿片类药物治疗或ECOG状态评分在3分以上)疾病进展、不可耐受的毒性或退出研究,患者将停止治疗。
接受本品联合泼尼松或泼尼松龙治疗的受试者中位年龄为71岁,接受安慰剂联合泼尼松或泼尼松龙治疗的受试者中位年龄为70岁。按人种分类,本品治疗组的受试者中有白种人520例(95.4%)、黑人15例(2.8%)、亚洲人4例(0.7%)及其他6例(1.1%)。两治疗组中,76%的受试者ECOG体能状态评分为0,24%的受试者评分为1。50%的受试者仅患有骨转移,31%患有骨转移和软组织或淋巴结转移,19%仅患有软组织或淋巴结转移。联合主要疗效终点为总生存期和影像学无进展生存期(rPFS)。除此之外,还采用以下指标评估疗效:至使用阿片类药物缓解癌症疼痛的时间、至细胞毒性化疗开始的时间、至ECOG体能状态评分恶化时间(与基线相比≥1分)、至PSA进展时间(根据前列腺癌工作组2[PCWG2]标准判定)。
影像学无进展生存期的评估采用连续的影像学检查,如骨病灶的评估采用PCWG2定义,软组织病灶的评估采用已改良的实体瘤疗效评价标准(RECIST 1.1)。rPFS的分析采用经中心实验室审查的影像学进展评估。
根据计划的rPFS分析,共有401例受试者出现有影像学证据的进展或发生死亡事件,本品治疗组150例(28%),安慰剂治疗组251例(46%)。两治疗组间的rPFS存在显著差异(见表7和图2)。
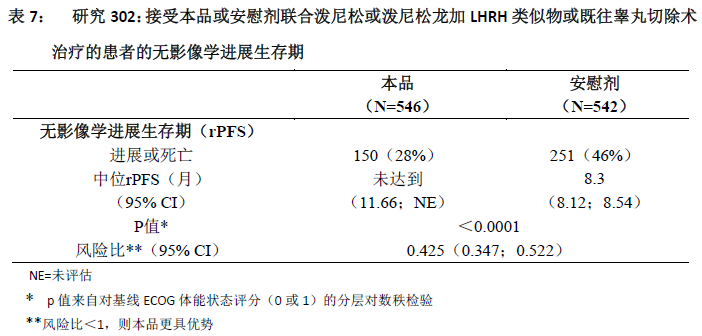
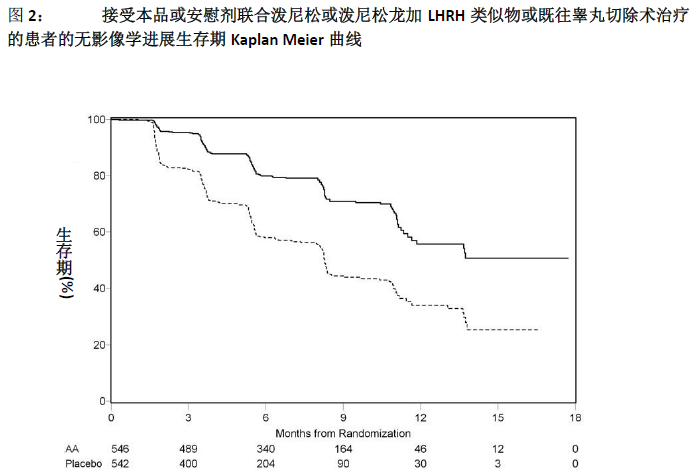
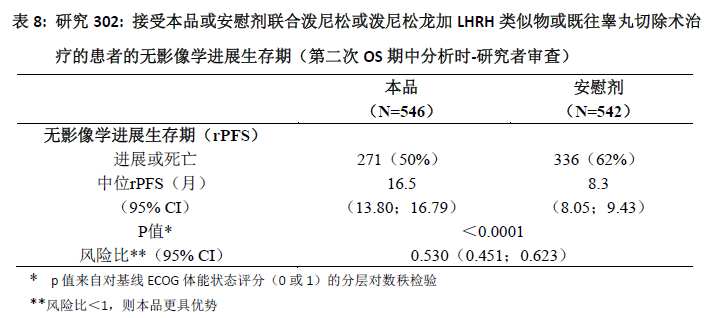
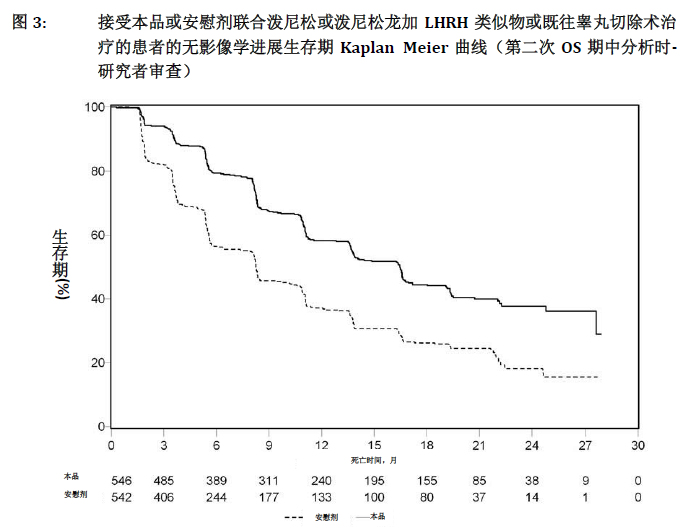
在对总生存期(OS)进行第二次期中分析前继续收集受试者数据。作为后续敏感性分析的研究者评估的rPFS的影像学结果见表8和图3。
607例受试者发生影像学进展或死亡:本品组和安慰剂组分别有271例(50%)和336例(62%)。与安慰剂组相比,本品治疗组的影像学进展或死亡风险降低了47%(HR=0.530;95% CI:[0.451;0.623],p<0.0001)。本品组和安慰剂组的中位rPFS分别为16.5个月和8.3个月。
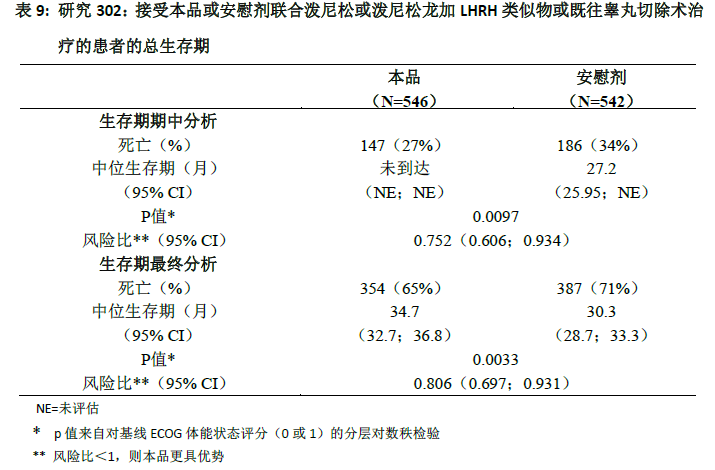
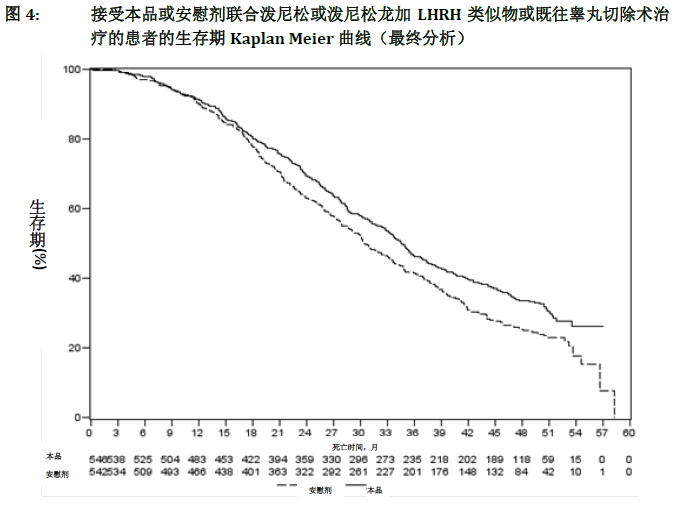
在观察到333例死亡事件后,进行了计划的总生存期(OS)期中分析(IA)。基于所观察到的临床获益,对本研究进行揭盲,并对安慰剂组受试者提供本品药物治疗。与安慰剂组相比,本品组受试者的总生存期较长,死亡风险降低25%(HR=0.752;95% CI:[0.606;0.934],p=0.0097),但OS结果尚不成熟,期中分析结果未达到预定停止试验的具有统计学意义的界值(见表9)。故此次IA后继续跟踪受试者生存情况。
在观察到741例死亡事件后,进行了计划的OS最终分析(中位随访时间为49个月)。本品治疗组和安慰剂治疗组分别有65%(546例中有354例)和71%(542例中有387例)受试者死亡。本品治疗组死亡风险降低19.4%(HR=0.806;95% CI:[0.697;0.931],p=0.0033),OS获益具有统计学意义,中位OS延长4.4个月(本品组为34.7个月,安慰剂组为30.3个月;见表9和图4)。尽管安慰剂组有44%的受试者后续接受了本品治疗,但本品组依然有显著的临床获益优势。
除总生存期和rPFS得到改善外,与安慰剂治疗相比,本品在下列所有次要终点中也表现出临床获益:
基于PCWG2标准确定的至PSA进展时间:本品治疗组和安慰剂组受试者至PSA进展的中位时间分别为11.1个月和5.6个月(HR=0.488;95% CI:[0.420;0.568],p<0.0001)。本品治疗组至PSA进展时间约为安慰剂组的两倍(HR=0.488)。本品治疗组中出现经证实的PSA缓解的受试者比例高于安慰剂组(62% vs. 24%;p<0.0001)。在有可测量的软组织病灶受试者中,本品治疗组观察到完全或部分缓解的受试者数量明显增加。
至使用阿片类药物时间:最终分析时,本品治疗组和安慰剂组受试者至使用阿片类药物的中位时间分别为33.4个月和23.4个月(HR=0.721;95% CI:[0.614;0.846],p<0.0001)。
至细胞毒性化疗开始的时间:本品治疗组和安慰剂组受试者至细胞毒性化疗开始的中位时间分别为25.2个月和16.8个月(HR=0.580;95% CI:[0.487;0.691],p<0.0001)。
至ECOG体能状态评分恶化≥1分的时间:本品治疗组和安慰剂组受试者至ECOG体能状态评分恶化≥1分的时间分别为12.3个月和10.9个月(HR=0.821;95% CI:[0.714;0.943],p=0.0053)。
下列研究终点体现了本品治疗具有统计学显著意义的优势:
客观缓解率:客观缓解率是指,有可测量病灶且按照RECIST标准取得了完全或部分缓解的受试者的比例(基线淋巴结大小需要≥2 cm才能视为一个靶病灶)。本品治疗组和安慰剂组中,在基线有可测量病灶且出现客观缓解的受试者比例分别为36%和16%(p<0.0001)。
疼痛:与安慰剂组相比,本品治疗组的平均疼痛强度进展风险显著降低18%(p=0.0490)。本品治疗组和安慰剂组至疼痛强度进展的中位时间分别为26.7个月和18.4个月。
至FACT-P(总分)恶化的时间:与安慰剂组相比,本品治疗组的FACT-P(总分)恶化风险降低22%(p=0.0028)。本品治疗组和安慰剂组至FACT-P(总分)恶化的中位时间分别为12.7个月和8.3个月。
中国患者临床试验数据 (研究3)
未经化疗的转移性去势抵抗性前列腺癌患者 (ABI-PRO-3002)
在位于亚洲(中国、马来西亚和泰国)和欧洲(俄罗斯)的42个研究中心进行的一项本品联合泼尼松/泼尼松龙(之后统称泼尼松)治疗无症状或有轻度症状的转移性去势抵抗性前列腺癌患者的随机、双盲、安慰剂对照的III期临床研究中(研究3), 受试者根据区域(亚洲或欧洲)和东部肿瘤协作组(ECOG)全身功能状态(PS)评分(0或1)分层,并随机分配(1:1)接受本品联合泼尼松或安慰剂联合泼尼松。合格受试者空腹接受1000mg本品(以4×250mg片剂给药)或4片安慰剂(每日1次)联合泼尼松5mg(每日2次)。
本研究共入组313名受试者(157名受试者:本品联合泼尼松,156名受试者:安慰剂联合泼尼松),其中中国患者入组238例。受试者接受治疗,直至疾病进展。研究规定的疾病进展包括:研究者确定受试者经历了PSA进展(PSA较最低值增加≥25%,绝对值增加≥2ng/ml,并且在≥3周后确认)、影像学进展(确认的骨扫描显示的进展或改良版RECIST 1.1标准规定的软组织疾病进展)、或临床进展(通过简明疼痛调查表—简表[BPI-SF]评估值≥4而确认疼痛进展,出现骨骼不良事件,泼尼松剂量增大或换用更强效的糖皮质激素,或开始使用新的全身抗癌治疗)。受试者也可因不可接受的毒性或个人选择而终止治疗。
疗效评价包括通过血清PSA浓度来评价的疾病进展以及生存状态评估。还进行以下评价:总生存期;客观缓解率;记录合并或后续用药;至开始细胞毒化学疗法治疗转移性前列腺癌的时间;基于患者报告的问卷调查结果测定的至疼痛进展的时间以及镇痛剂的使用得分来衡量至镇痛进展时间;通过病史回顾以及体格检查确定的至ECOG 体力状态临床恶化的时间。
两组间的患者人口统计学数据和基线疾病特征总体是均衡的。患者中位年龄为71岁(48~90岁)。至方案预先设定的中期分析时,有效性结果显示同用安慰剂联合泼尼松治疗的受试者相比,用本品联合泼尼松治疗的受试者的PSA进展风险降低58%(HR=0.418,p<0.0001);中国患者的结果与总体的结果一致,相比于安慰剂联合泼尼松治疗组,使用本品治疗的受试者PSA进展风险降低了44%(HR=0.563, p=0.0173)。
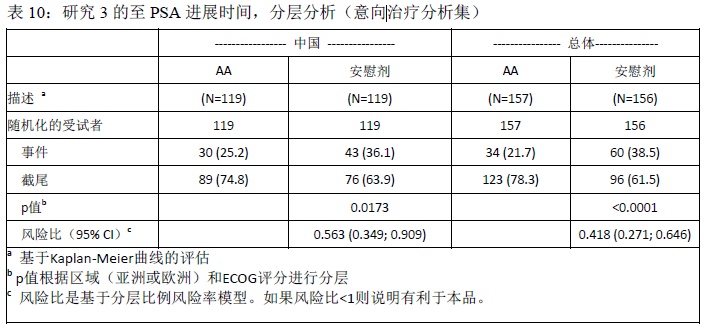
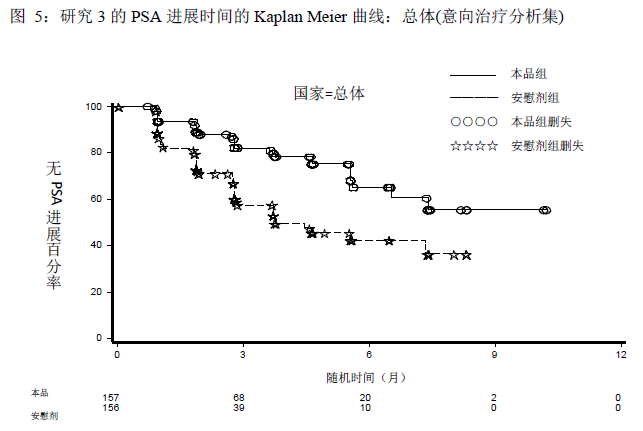
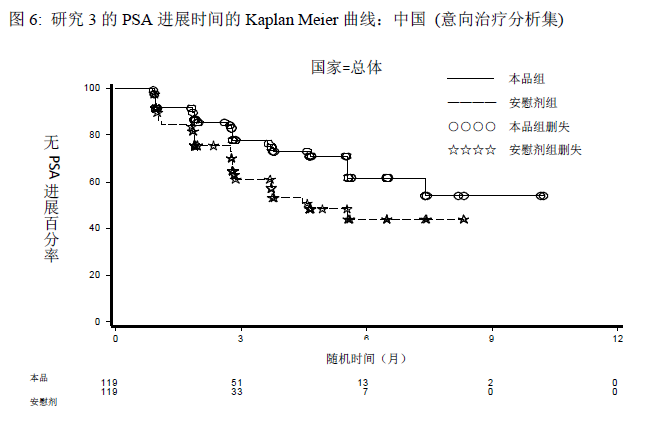
与安慰剂联合泼尼松治疗的受试者(31%)相比,本品联合泼尼松治疗的受试者的PSA缓解率(67%)显著提高(p<0.0001)。中国患者的结果与总体人群的结果一致,本品联合泼尼松治疗组和安慰剂联合泼尼松治疗组的PSA缓解率分别是67%和37%(p<0.0001)。客观缓解率(完全缓解和部分缓解,CR+PR)表明,本品联合泼尼松治疗的受试者的缓解率(23%)比安慰剂联合泼尼松治疗的受试者(5%)显著升高,前者约为后者的4.8倍(p=0.0369)。所有的缓解均为部分缓解。中国患者的结果与总体人群的结果一致,本品联合泼尼松治疗组和安慰剂联合泼尼松治疗组的客观缓解率分别是32% 和0%(p=0.0052)。
安全性结果显示最常报告的不良事件(本品或安慰剂组有≥10%受试者报告)为骨痛、关节痛、背痛、肢端疼痛和高血压。本品组有17%的受试者报告了3或4级不良事件,安慰剂组有21%;两组分别有4%和7%的受试者报告了严重不良事件;分别有3%和4%的受试者报告了导致死亡的不良事件;分别有3%和5%的受试者报告了导致停药的不良事件。
研究3的结果证实了在未接受过化疗的mCRPC受试者中醋酸阿比特龙联合泼尼松治疗可获得有利的临床获益-风险比。本研究中醋酸阿比特龙组的安全性特征与全球关键性III期研究2大体一致。未观察到新的安全性信号。
中国患者临床试验数据 (研究4)
既往接受过多西他赛化疗的转移性去势抵抗性前列腺癌患者(ABI-PRO-3001)
中国患者中进行的另一项本品联合泼尼松治疗多西他赛化疗失败的转移性去势抵抗性前列腺癌患者的III期、随机、双盲、安慰剂对照研究(研究4)。所有合格的受试者将在第1周期第1天按2:1的比例随机化分配,分别接受1,000 mg醋酸阿比特龙(以4 x 250 mg片剂给药,每日1次)或安慰剂(4片,每日1次),联合泼尼松治疗(5 mg,每日两次)。两治疗组间不允许交叉。每个治疗周期持续28天。
本研究总计招募并随机化214例受试者。ITT和安全性分析集均包括醋酸阿比特龙组143例受试者和安慰剂组71例受试者。受试者接受治疗直至出现疾病进展。疾病进展是指PSA进展(前列腺特异性抗原工作组[PSAWG]标准)和影像学进展(骨扫描进展或根据改良的实体瘤疗效评价标准[RECIST 1.1]确定的软组织疾病进展),伴有或不伴有临床进展(疼痛进展[通过简明疼痛调查表-简表{BPI-SF}评估],出现骨骼相关不良事件,泼尼松剂量增加或换用更强效的糖皮质激素,或使用额外的阿片类镇痛剂治疗前列腺癌相关的体征和症状);或临床进展,同时伴有PSA进展和影像学进展中的一项或两项。
通过测定受试者研究期间的PSA水平评估疗效。主要疗效终点是TTPP,定义为从随机化至PSA进展的时间间隔(根据PSAWG标准定义)。次要疗效终点包括:总生存期、PSA缓解率、客观缓解率(ORR)、生活质量(QoL)总评分及前列腺癌治疗功能评价(FACT-P)各子量表评分、至疼痛进展时间、使用BPI-SF最严重疼痛强度评分和止痛药使用评分获得的疼痛缓解的受试者比例,以及通过简明疲劳量表(BFI)评估的疲劳程度。
受试者的中位年龄为68岁。大多数受试者基线疾病进展仅为PSA进展。醋酸阿比特龙组和安慰剂组分别有95.1%和94.4%的受试者出现骨转移;基线时有疼痛症状的受试者比例分别为72.7%和66.2%。所有受试者均经药物或手术去势(61.7%受试者接受过睾丸切除术,54.7%受试者接受过LHRH激动剂治疗)。所有受试者均接受过化疗。在双盲治疗期间,醋酸阿比特龙组的中位治疗持续时间是32.3周,安慰剂组为16.9周。醋酸阿比特龙组中位给药时间为9个周期,而安慰剂组为5个周期。随访期接受开放式醋酸阿比特龙给药的受试者中,中位治疗持续时间为16.0周,中位给药时间为4个周期(16周)。
疗效结果显示与安慰剂组相比,醋酸阿比特龙组的PSA进展风险降低了49%(HR=0.506;p=0.0001)。除基线ECOG体力状态评分为2的受试者(由于样本量较小)外,所有其他亚组分析均显示醋酸阿比特龙显著改善受试者的TTPP。
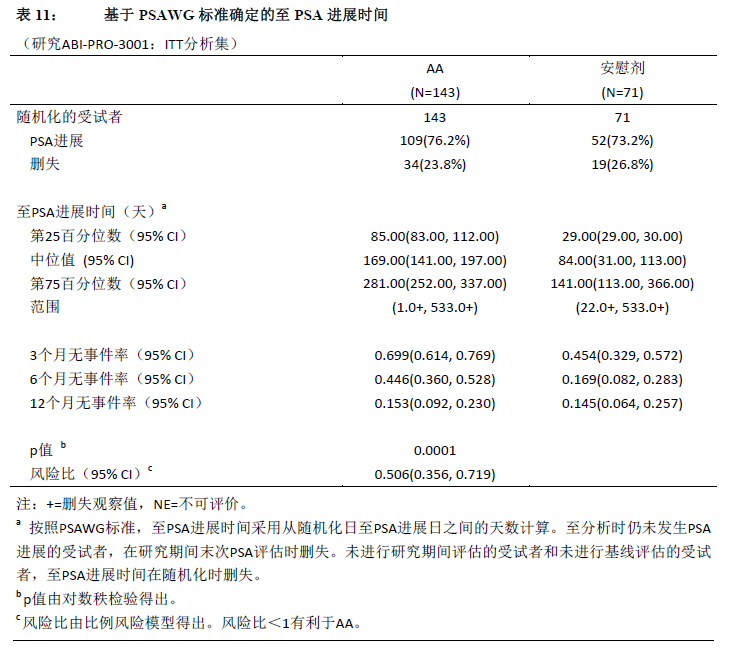
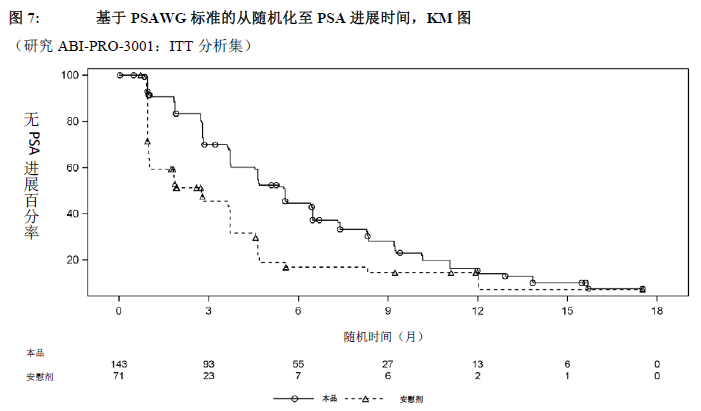
对于既往以多西他赛为基础的化疗失败的中国mCRPC受试者,使用醋酸阿比特龙联合泼尼松治疗显著改善了TTPP并获得了较高的PSA缓解率。同时,也观察到了OS的临床有利趋势 (HR=0.604 [0.356, 1.026]),HR与研究1 COU-AA-301(HR=0.646 [0.543, 0.768])相似。醋酸阿比特龙组受试者确认的PSA缓解率(49.7%)显著高于安慰剂组受试者(14.1%;相对风险=3.525;p<0.0001)。与醋酸阿比特龙组(37.1%)相比,安慰剂组(50.7%)中出现疼痛进展事件的受试者比例较高。相比于安慰剂,醋酸阿比特龙显著地降低了疼痛进展的风险,降低程度为50%(HR=0.496;p=0.0014)。在疼痛评分为4或以上的受试者中,醋酸阿比特龙组的疼痛改善率较高,两组差异为23%。
双盲治疗期内,醋酸阿比特龙组有32.2%的受试者报告3至4级不良事件,安慰剂组有28.2%;两组分别有14.0%和19.7%的受试者报告治疗期间严重不良事件;分别有7.0%和9.9%的受试者报告导致治疗终止的不良事件;分别有6.3%和12.7%的受试者报告导致死亡的不良事件。
研究ABI-PRO-3001的结果证实了在接受过化疗的mCRPC受试者中醋酸阿比特龙联合泼尼松治疗可获得有利的获益-风险比。本研究中醋酸阿比特龙组的安全性特征与全球关键性III期研究(COU-AA-301)大体一致。未观察到新的安全性信号。
【药理毒理】
药理作用
醋酸阿比特龙在体内转化成阿比特龙,阿比特龙是一种雄激素生物合成抑制剂,可抑制17α-羟化酶 / C17,20-裂解酶(CYP17),后者在睾丸、肾上腺和前列腺肿瘤组织中表达并且是雄激素生物合成所必需的。
CYP17催化两个连续的反应:1)通过17α-羟化酶催化孕烯醇酮和孕酮转化成各自的17α-羟基衍生物;2)随后在C17、20裂解酶催化下分别形成脱氢表雄酮和雄烯二酮。脱氢表雄酮和雄烯二酮均为雄激素而且是睾酮的前体。阿比特龙对CYP17的抑制作用也导致肾上腺盐皮质激素生成增加。
雄激素敏感性前列腺癌可对雄激素水平降低治疗法产生应答。雄激素阻断疗法如促性腺激素释放激素(GnRH)激动剂或睾丸切除术可降低睾丸中雄激素生成,但不能影响肾上腺或肿瘤中雄激素生成。
在安慰剂对照III期临床试验中,醋酸阿比特龙引起患者血清睾酮及其他雄激素水平降低。临床使用中,无需监测本品对血清睾酮水平的影响。
血清前列腺特异性抗原(PSA)水平可能变化,但尚未证实其与患者个体的临床获益具有相关性。
毒理研究
重复给药毒性:在大鼠13周和26周、猴13周和39周重复给药毒性试验中,在相当于约人临床暴露量(AUC)一半的情况下,醋酸阿比特龙可引起循环睾酮水平下降。因此,在雄性和雌性生殖系统、肾上腺、肝脏、垂体(仅见于大鼠)和雄性乳腺中观察到器官重量下降和一定毒性。生殖器官的变化与醋酸阿比特龙的抗雄激素药理活性一致。在≥50 mg/kg/天(接近于人AUC)剂量给药26周后,观察到大鼠白内障发生率呈剂量依赖性增加。猴39周试验中,在更高的剂量(高于人AUC的2倍)下未观察到白内障。在4周恢复期后,由醋酸阿比特龙引起的所有其他毒性得到逆转或部分恢复。
遗传毒性: 醋酸阿比特龙和阿比特龙Ames试验、人淋巴细胞细胞遗传学试验和大鼠微核试验结果均为阴性。
生殖毒性:根据动物试验结果,醋酸阿比特龙有损伤人类生殖功能和生育力的可能性。在雄性大鼠(13和26周)和猴(39周)重复给药毒性试验中,≥50 mg/kg/天(大鼠)和≥250 mg/kg/天(猴)剂量下可见生殖系统萎缩、无精/精液减少症以及增生性改变,其效应与阿比特龙的抗雄激素药理活性一致。在大鼠和猴中观察到这些效应的AUC分别是接近和大约0.6倍于人的临床暴露量。
在大鼠生育力与早期胚胎发育毒性试验中,雄性大鼠给予30mg/kg/天以及更高剂量4周可见生殖系统器官重量降低、精子计数减少、精子活力降低、精子形态改变,生育力下降。未给药的雌性大鼠与给予30mg/kg/天剂量的雄性大鼠交配,导致黄体数量减少、着床和存活的胚胎减少,着床前丢失率升高。醋酸阿比特龙对雄性大鼠生育力的影响可在停药16周后恢复。雌性大鼠于交配前两周至妊娠第7天给予醋酸阿比特龙30mg/kg/天以及更高剂量,可引起动情周期不规则或延迟的发生率以及着床前丢失率升高(300mg/kg/天)。给予醋酸阿比特龙的雌性大鼠在交配能力、生育力及其子代各方面的参数未见差异。醋酸阿比特龙对雌性大鼠的影响可在停药4周后恢复。按照体表面积换算,大鼠30mg/kg/天的剂量约为人推荐剂量(1000mg/天)的0.3倍。
大鼠胚胎/胎仔发育毒性试验中,大鼠于妊娠第6~17天经口给予醋酸阿比特龙10、30、100mg/kg/天(分别约相当于人AUC的0.03倍、0.1倍与0.3倍),可引起发育毒性,≥10mg/kg/剂量可见胚胎/胎仔死亡(着床后丢失率与吸收胎率升高、活胎数减少),胚胎发育延迟(骨骼)与双侧输尿管扩张,≥30mg/kg/剂量可引起胎仔肛门生殖器距离缩短,100mg/kg/剂量可引起胎仔体重减低。≥10mg/kg/剂量可引起母体毒性。
致癌性:大鼠经口给药两年致癌性试验显示:雄性大鼠给予醋酸阿比特龙5、15和50 mg/kg/天,雌性大鼠15、50和150 mg/kg/天,各剂量均可引起睾丸间质细胞腺瘤和间质细胞癌,认为与阿比特龙的药理活性有关。醋酸阿比特龙在人暴露量的0.8倍时,对雌性小鼠未见致癌性。在Tg.rasH2转基因小鼠6个月致癌性试验中未见致癌性。
【药代动力学】
已在健康受试者和mCRPC患者中进行了本品及其活性代谢物阿比特龙药代动力学研究。在体内,本品迅速转化成阿比特龙。临床研究中,>99%分析样本中本品血浆浓度低于检测水平
吸收
mCRPC患者口服本品后,阿比特龙中位达峰时间为2小时。稳态下观察到阿比特龙蓄积,其暴露量(稳态AUC)是1000 mg本品单次给药的2倍。
在mCRPC患者中,1000 mg每日1次剂量下Cmax和AUC稳态值(均数± SD)分别为226±178 ng/ml和1173 ± 690 ng∙h/ml。在剂量范围250-1000 mg内,未观察到剂量比例性的重大偏离。剂量从1000mg增至2000mg时,暴露量没有显著增加(平均AUC增加8%)。
本品与食物同时服用时,阿比特龙全身暴露量升高。本品与低脂餐(7%脂肪,300卡路里)同时服用时,阿比特龙Cmax和AUC0-∞分别增加至7倍和5倍左右;本品与高脂餐(57%脂肪,825卡路里)同时服用时,这些值分别增加至17倍和10倍左右。鉴于食物的多样性和可变性,本品与食物同时服用可能会导致暴露量升高且易变。故至少在服药前2小时内和服药后1小时内不能进食。另外,须用水整片送服本品(见【用法用量】)。
分布和蛋白结合
阿比特龙与人血浆蛋白、白蛋白和α-1酸性糖蛋白高度结合(>99%)。稳态表观分布容积(均数± SD)为19669±13358 L。体外研究显示在临床相关浓度范围下,本品和阿比特龙均不是P-糖蛋白的底物,而本品是P-糖蛋白的抑制剂。尚未对其他转运蛋白进行研究。
代谢
口服14C-醋酸阿比特龙胶囊后,醋酸阿比特龙被水解成阿比特龙(活性代谢物)。此过程可能是在酯酶(尚未鉴别酯酶)作用下转化,而不是由CYP介导。阿比特龙在人血浆中的两个主要循环代谢物为硫酸阿比特龙(无活性)和N-氧化硫酸阿比特龙(无活性),各占暴露量的43%左右。CYP3A4和SULT2A1参与N-氧化硫酸阿比特龙形成,且SULT2A1也参与硫酸阿比特龙形成。
排泄
在mCRPC患者中,阿比特龙在血浆中的平均终末半衰期(均数± SD)为12±5小时。口服14C-醋酸阿比特龙后,从粪便和尿液中分别回收约88%和5%放射性剂量。粪便中存在的主要化合物为本品原形和阿比特龙(分别为给药剂量的55%和22%)。
肝功能损害患者
在基线轻度(n = 8)或中度(n = 8)肝功能损害(分别为Child-Pugh A 和B级)受试者和8例肝功能正常的健康受试者中,评估了阿比特龙的药代动力学。基线轻度和中度肝功能损害受试者空腹单次口服1000 mg后,阿比特龙的全身暴露量分别增加约1.1倍和3.6倍。在轻度和中度肝功能损害受试者中,阿比特龙的平均半衰期分别延长至18和19小时。尚未在基线严重肝功能损害(Child-Pugh C级)患者中研究本品 (见【用法用量】和【注意事项】)。
另一项试验在8例基线有严重肝功能损害(Child-Pugh C级)的受试者和8例肝功能正常的健康受试者中分析了阿比特龙的药代动力学。与肝功能正常的受试者相比,基线有严重肝功能损害受试者的阿比特龙全身暴露量(AUC)增加约7倍。此外,试验发现,基线有严重肝功能损害受试者的平均蛋白结合率比肝功能正常受试者低,因而严重肝功能损害受试者的游离药物部分的暴露量增加了2倍。(见【用法用量】)
肾功能损害患者
在接受稳定血液透析方案的终末期肾病患者(n = 8)和肾功能正常的受试者(n = 8)中,评估了阿比特龙的药代动力学。在终末期肾病患者组中,透析后1小时空腹单次口服1000 mg 本品,并在服药后96小时内采样用于药代动力学分析。结果显示与肾功能正常受试者相比,接受透析的终末期肾病受试者单次口服1000 mg后阿比特龙全身暴露量并未升高(见【注意事项】)。
药物相互作用
使用人肝微粒体的体外研究显示,阿比特龙是CYP1A2、CYP2D6和CYP2C8的强抑制剂,且是CYP2C9、CYP2C19和CYP3A4/5的中度抑制剂。
一项体内药物相互作用试验中,本品 1000 mg每日一次与泼尼松 5 mg每日2次合并给药时,右美沙芬(CYP2D6底物)的Cmax和AUC分别增加2.8和2.9倍。右美沙芬活性代谢物右啡烷的AUC增加1.3倍左右(见【药物相互作用】)。
一项临床研究中,测定本品1000 mg每日1次(加泼尼松5 mg每日2次)对单次口服100 mg茶碱(CYP1A2底物)的影响。未观察到茶碱全身暴露量升高。
阿比特龙在体外是CYP3A4的底物。尚未在体内评估强CYP3A4抑制剂或诱导剂对阿比特龙药代动力学的影响。须避免或慎用强CYP3A4抑制剂和诱导剂(见【药物相互作用】)。
QT间期延长
在一项多中心开放单臂临床试验中,33位mCRPC患者在进餐前1小时或进餐后2小时服用了1000mg本品,每日1次,同时合并服用5mg泼尼松,每日2次。直到第2周期的第2天QTc间期较基线没有大的变化(如>20ms)。然而,由于临床试验设计的局限性,不能完全排除本品可能小幅延长QTc间期(如
【贮藏】
15-30°C以下保存。
【包装】
高密度聚乙烯圆瓶,120片/瓶
【有效期】
24个月。
【执行标准】
JX20130141
信息来源:百度百科