阿昔替尼(英利达)与阿维单抗联用一线治疗晚期肾癌。一项临床试验研究了此项联用的安全性和有效性。临床试验结果显示此项联用具有统计学上的临床意义。
阿昔替尼(英利达)与阿维单抗联用治疗晚期肾细胞癌患者。
JAVELIN Renal 101 试验 (NCT02684006) 证明了阿昔替尼(英利达)与阿维单抗联用的疗效和安全性,这是一项随机、多中心、开放标签的研究,在 886 名未经治疗的晚期肾癌患者中进行了阿昔替尼(英利达)与阿维单抗联用测试,无论肿瘤 PD- L1 表达情况,患有自身免疫性疾病或需要全身免疫抑制的病症的患者排除在外。
根据东部肿瘤协作组 (ECOG) 表现状态 (PS)(0 对 1)和地区(美国与加拿大/西欧与世界其他地区)对随机化分组。患者被随机分配 (1:1) 到以下治疗组之一:
阿昔替尼(英利达)5 mg每天两次口服,每2周与阿维单抗 10 mg/kg静脉输注联用 (N=442)。患者耐受阿昔替尼(英利达) 5 mg 每天 2 次,无 2 级或更大阿昔替尼(英利达)-相关不良事件连续 2 周可增加至 7 mg 和随后至 10 mg 每天 2 次。如果出现不可买手毒性,可以中断或减至 3 mg 每天两次和随后至 2 mg 每天两次以控制不良反应。
舒尼替尼 50 mg 每天口服一次,持续 4 周,然后停药 2 周 (N=444),直至影像学或临床进展或出现不可接受的毒性。
用阿昔替尼(英利达)和阿维单抗治疗持续到 RECIST v1.1 定义的疾病进展,或出现不可接受的毒性。如果患者临床稳定并且被研究者认为获得临床获益,则允许阿昔替尼(英利达)和阿维单抗的给药超过 RECIST 定义的疾病进展。肿瘤状态评估在基线时进行,在随机分组后 6 周时进行,然后每 6 周进行一次,直至随机化后 18 个月,此后每 12 周进行一次,直至 BICR 记录证实疾病进展。
基线特征为中位年龄 61 岁(范围:27 至 88 岁),38% 的患者为 65 岁或以上,75% 为男性,75% 为白人,ECOG PS 为 0 (63%) 或 1 ( 37%)。国际转移性肾细胞癌数据库 (IMDC) 风险组的患者分布为 21% 有利、62% 中等和 16% 差。
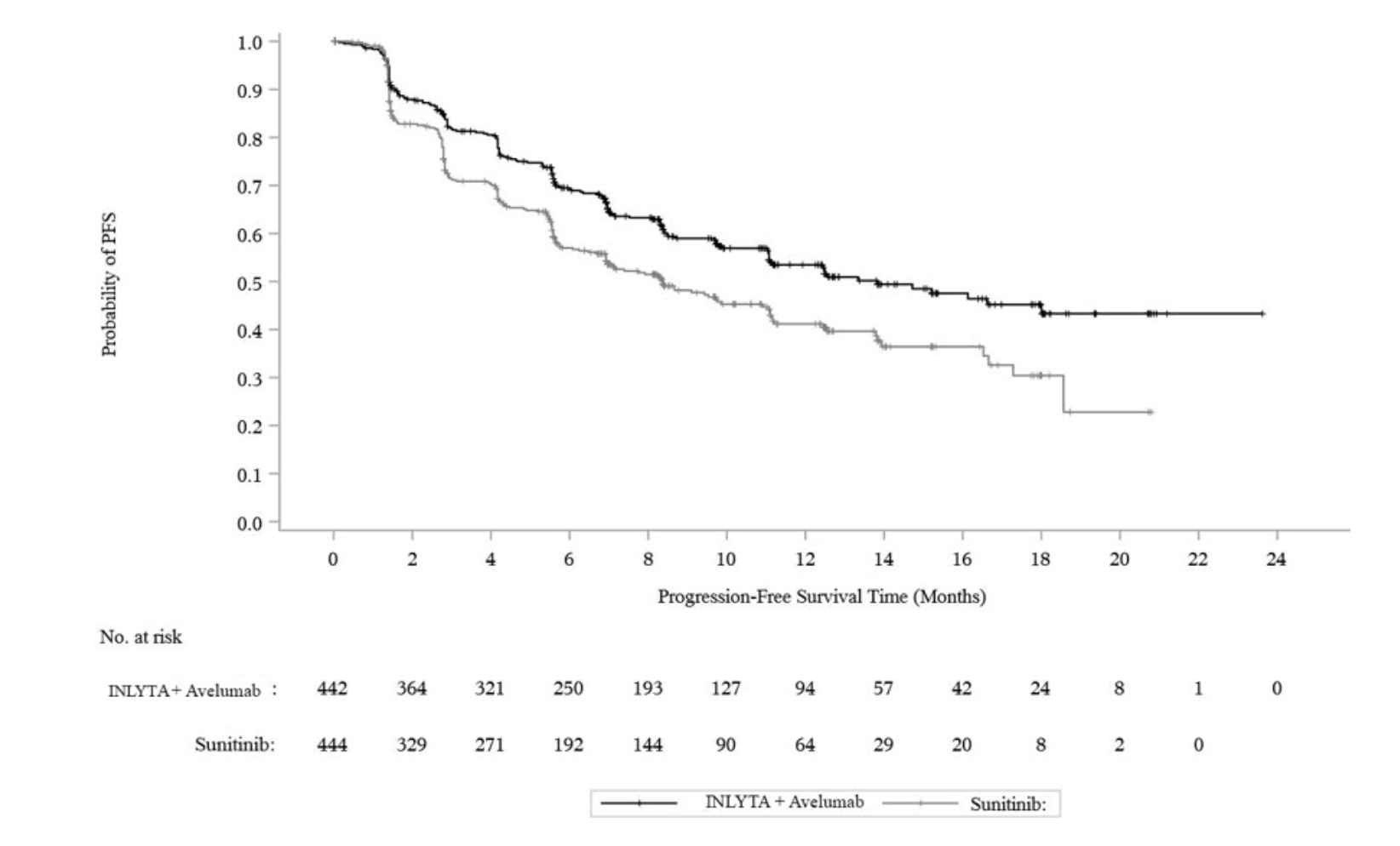
主要疗效结果指标是无进展生存期 (PFS),由 BICR 使用 RECIST v1.1 评估,以及 PD-L1 阳性肿瘤患者使用临床试验测定(PD-L1 表达水平)评估的总生存期 (OS) ≥1%)。由于 PFS 在 PD-L1 阳性肿瘤患者中具有统计学显着性 [HR 0.61 (95% CI: 0.48, 0.79)],因此在 ITT 人群中进行了测试,并且还证明了 ITT 人群中 PFS 的统计学显着改善.
中位总生存期随访 19 个月,总生存期数据不成熟,ITT 人群中有 27% 的患者死亡。
JAVELIN Renal 101 试验-ITT 的疗效结果
疗效终点(基于BICR评估) | 阿昔替尼(英利达)联合阿维单抗(N=422) | 苏尼替尼 (N=444) |
无进展生存期(PFS) | 180(41) | 216(49) |
事件(%) | 13.8(11.1东北) | 8.4(6.9,11.1) |
月中位数(95% CI) | 0.69(0.56,0.84) |
客观缓解率(ORR) | 0.0002 |
客观缓解率n(%) | 222(51.4) | 114(25.7) |
(95%置信区间) | (46.6,56.1) | (21.7,30.0) |
完全缓解(CR)n(%) | 15(3,4) | 8(1,8) |
部分缓解(CR)n(%) | 212(48) | 106(24) |
基于 BICR 评估的 PFS 的 KM 估计 – ITT
总结: 阿昔替尼(英利达)联合阿维单抗一线治疗晚期肾癌的疗效和安全性在临床试验中已经得到证实。患者在接受治疗时,要监测其不良反应,并及时调整剂量或永久停药。