富马酸丙酚替诺福韦片,该药用于治疗成人和青少年(12岁以上,体重至少为35kg)的慢性乙型肝炎(HBV)。 2024年8月,国家药监局发布公告决定对富马酸丙酚替诺福韦片等含丙酚替诺福韦药品说明书内容进行统一修订。
【性状】
本品为黄色、圆形的薄膜衣片。除去包衣后,显白色或类白色。片剂直径 8mm,一面凹刻有“GSI”,另一面凹刻有“25”。
【规格】
本品含富马酸丙酚替诺福韦,以丙酚替诺福韦计为25mg。
【禁忌】
对活性成分或以下所列任一赋形剂过敏:α乳糖、微晶纤维素、交联羧甲基纤维素钠、硬脂酸镁、聚乙烯醇、二氧化钛、聚乙二醇、滑石粉和氧化铁黄。
【注意事项】
1、肝炎恶化
停止治疗后突发
警告:已有报告指出,停止乙型肝炎治疗的患者出现了肝炎急性加重的情况(通常与血浆中 HBV DNA 水平升高相关)。大部分病例属于自限型,但严重加重的情况(包括致命性结局)可能在停止乙型肝炎治疗之后出现。应在停止乙型肝炎治疗至少 6 个月内,通过临床和实验室随访定期进行肝功能监测。如果合适,可能需要恢复乙型肝炎治疗。
在进展期肝病或肝硬化患者中,不建议停止治疗,因为治疗后肝炎加重可能导致肝功能失代偿。在失代偿期肝病患者中,肝病突发尤其严重,有时甚至致命。
治疗期间突发
慢性乙型肝炎自发性加重相对较为常见,特点是血清丙氨酸氨基转移酶 (ALT) 短暂增加。开始抗病毒治疗后,一些患者的血清 ALT 可能有所增加。在代偿性肝病患者中,此类血清ALT 增加通常不伴有血清胆红素浓度增加或肝功能失代偿。肝硬化患者在肝炎恶化后出现肝功能失代偿的风险可能更高,因此,应在治疗期间加以严密监测。
2、HBV 传播
必须告知患者富马酸丙酚替诺福韦片不能预防通过性接触或血液污染的方式传播 HBV 的风险。必须继续采取适当预防措施。
3、失代偿性肝病患者
对于患有失代偿性肝病以及 Child Pugh Turcotte (CPT) 评分 >9(即C 级)的 HBV 感染患者,尚无富马酸丙酚替诺福韦片安全性和疗效方面的数据。这些患者出现严重肝脏或肾脏不良反应的风险可能更高。因此,应严密监测此患者人群的肝胆和肾脏各项指标和参数(参见【药理毒理】)。
4、乳酸性酸中毒/严重脂肪性肝肿大
单独使用核苷类似物(包括富马酸替诺福韦酯或其他替诺福韦前体药物)治疗或联用其它抗逆转录病毒药物治疗时,曾有发生乳酸性酸中毒和严重脂肪性肝肿大的报告,包括出现致死病例。任何患者的临床或实验室结果如果提示有乳酸性酸中毒或显著的肝毒性(可能包括肝肿大和脂肪变性,即便转氨酶没有显著升高),应当暂停富马酸丙酚替诺福韦片治疗。
5、肾功能损害
肌酐清除率< 30 mL/min的患者
在 CrCl≥15mL/min 但<30mL/min 的患者以及 CrCl<15mL/min 且正在接受血液透析的患者中,每日一次富马酸丙酚替诺福韦片的使用是基于极为有限的药代动力学数据和建模与模拟而确定。尚无使用富马酸丙酚替诺福韦片治疗 CrCl <30 mL/min 的 HBV 感染患者的安全性数据。
不推荐富马酸丙酚替诺福韦片用于 CrCl<15mL/min 且未接受血液透析的患者(参见【用法用量】)。
6、肾毒性
无法排除丙酚替诺福韦给药导致长期暴露于低水平替诺福韦而引起肾毒性的潜在风险(请参见【药理毒理】)。
7、合并感染 HBV 和丙型肝炎或丁型肝炎病毒的患者
尚无关于富马酸丙酚替诺福韦片在合并感染丙型肝炎或丁型肝炎病毒患者中的安全性和疗效的数据。应遵循关于丙型肝炎治疗的联合用药指南(参见【药物相互作用】)。
8、乙型肝炎和 HIV 合并感染
由于存在出现 HIV 耐药性的风险,不建议将富马酸丙酚替诺福韦片用于 HIV-1 感染的治疗。尚未确定富马酸丙酚替诺福韦片在合并感染 HIV-1 和 HBV 的患者中的安全性和疗效。在开始富马酸丙酚替诺福韦片治疗前,应为所有 HBV 感染患者进行 HIV 抗体检测,如果为阳性,应使用为合并感染 HIV-1 的患者推荐的相应抗逆转录病毒联合方案。
9、与其他药品合用
富马酸丙酚替诺福韦片不应与含丙酚替诺福韦、富马酸替诺福韦酯或阿德福韦酯的产品合用。
10、乳糖不耐受
富马酸丙酚替诺福韦片含有α乳糖。因此,患有半乳糖不耐受、Lapp 乳糖酶缺乏症或葡萄糖-半乳糖吸收不良的罕见遗传问题的患者不应服用此药品。
11、对驾驶及操作机械能力的影响
富马酸丙酚替诺福韦片对驾驶和操作机械的能力无影响或影响可忽略。应该告知患者在富马酸丙酚替诺福韦片治疗期间已有头晕报告。
【孕妇及哺乳期妇女用药】
1、妊娠
尚无孕妇使用丙酚替诺福韦的数据或此类数据非常有限(不足 300 例妊娠结局)。不过,大量关于孕妇的数据(超过 1000 例暴露结局)表明未出现与富马酸替诺福韦酯相关的畸形或胎儿/新生儿毒性。
关于生殖毒性,动物研究未表明存在直接或间接有害影响(参见【药理毒理】)。
如有必要,可考虑在妊娠期间使用富马酸丙酚替诺福韦片。
2、哺乳
尚不清楚丙酚替诺福韦是否会分泌到人乳汁中。但是,动物研究结果已表明,替诺福韦可分泌至乳汁中。关于替诺福韦在新生儿/婴儿中的影响的信息不充分。
不能排除对哺乳期儿童的风险。因此,哺乳期间不应使用富马酸丙酚替诺福韦片。
3、生育力
尚无富马酸丙酚替诺福韦片影响人类生育力的相关数据。动物研究未表明丙酚替诺福韦会对生育力产生有害影响。
【儿童用药】
尚未确定富马酸丙酚替诺福韦片在 12 岁以下或体重<35kg 的儿童中的安全性和疗效。尚无可用数据。
【老年用药】
无需针对年龄为 65 岁及以上的患者进行富马酸丙酚替诺福韦片剂量调整(参见【药理毒理】)。
【药物相互作用】
仅在成人中进行了相互作用研究。
富马酸丙酚替诺福韦片不应与含富马酸替诺福韦酯、丙酚替诺福韦或阿德福韦酯的药品合用。
可能影响丙酚替诺福韦的药品
丙酚替诺福韦由 P‑gp 和乳腺癌耐药蛋白 (BCRP) 转运。预计 P-gp 诱导剂类药品会降低丙酚替诺福韦血浆浓度,这可能导致富马酸丙酚替诺福韦片失去疗效(见表2)。
富马酸丙酚替诺福韦片与抑制 P‑gp 和/或 BCRP 的药品合用可能增加丙酚替诺福韦血浆浓度。
在体外,丙酚替诺福韦是 OATP1B1 和 OATP1B3 的底物。丙酚替诺福韦的体内分布可能会受到 OATP1B1 和/或 OATP1B3 活性的影响。
丙酚替诺福韦对其他药品的影响
在体外,丙酚替诺福韦不是 CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19 或 CYP2D6 的抑制剂。在体内,其也并非 CYP3A 的抑制剂或诱导剂。
在体外,丙酚替诺福韦不是人尿苷二磷酸葡糖醛酸基转移酶 (UGT)1A1 的抑制剂。尚不清楚丙酚替诺福韦是否是其他 UGT 酶的抑制剂。
下表2中总结了富马酸丙酚替诺福韦片与可能合用的药品之间的药物相互作用信息(“↑”表示增加,“↓”表示降低,“↔”表示无变化;“b.i.d.”表示每日两次,“s.d.”表示单次给药,“q.d.”表示每日一次;“IV”表示静脉方式)。所述药物相互作用基于采用丙酚替诺福韦开展的研究得出,或者是使用富马酸丙酚替诺福韦片时可能出现的药物相互作用。
表2:富马酸丙酚替诺福韦片与其他药品之间的相互作用
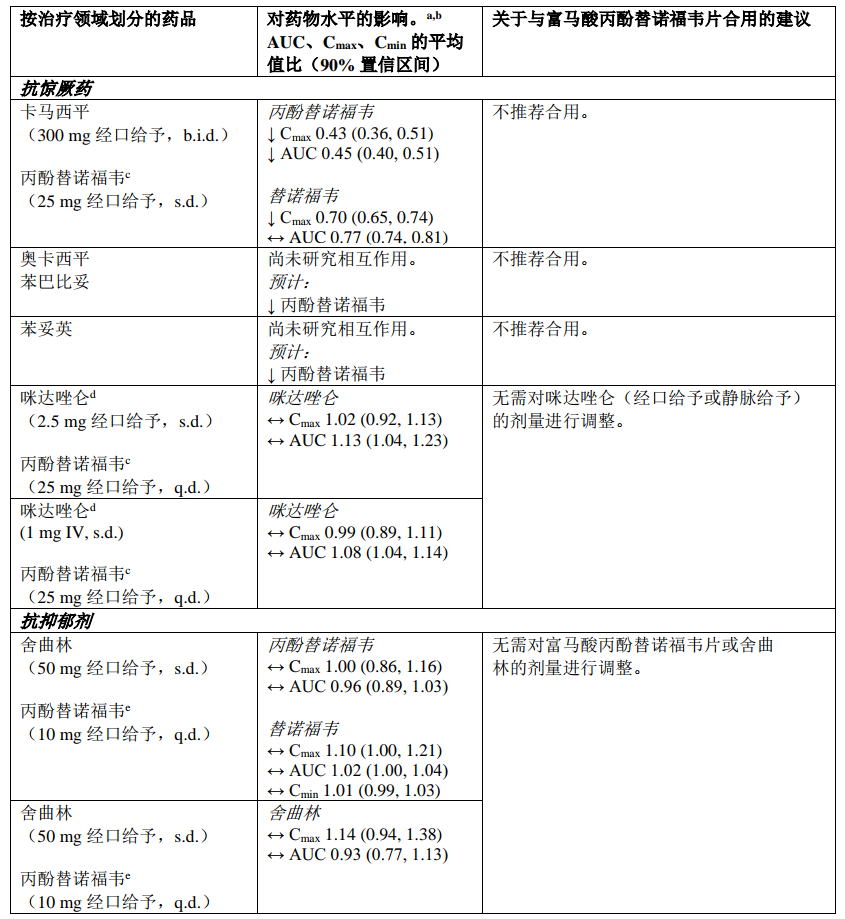
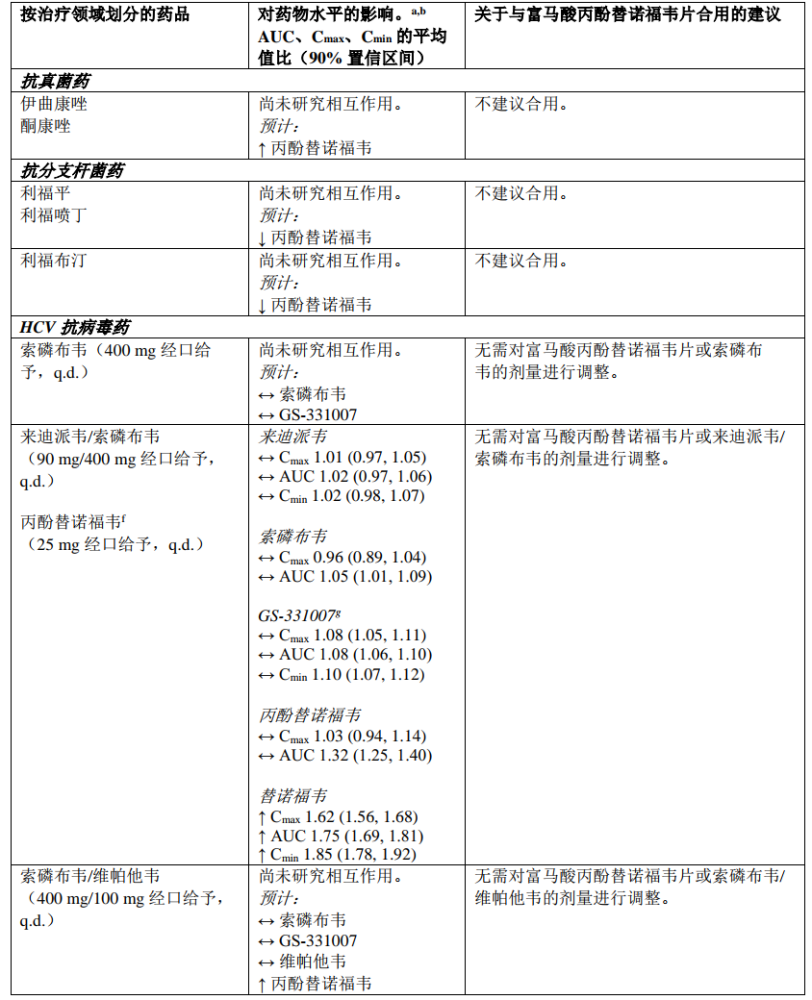
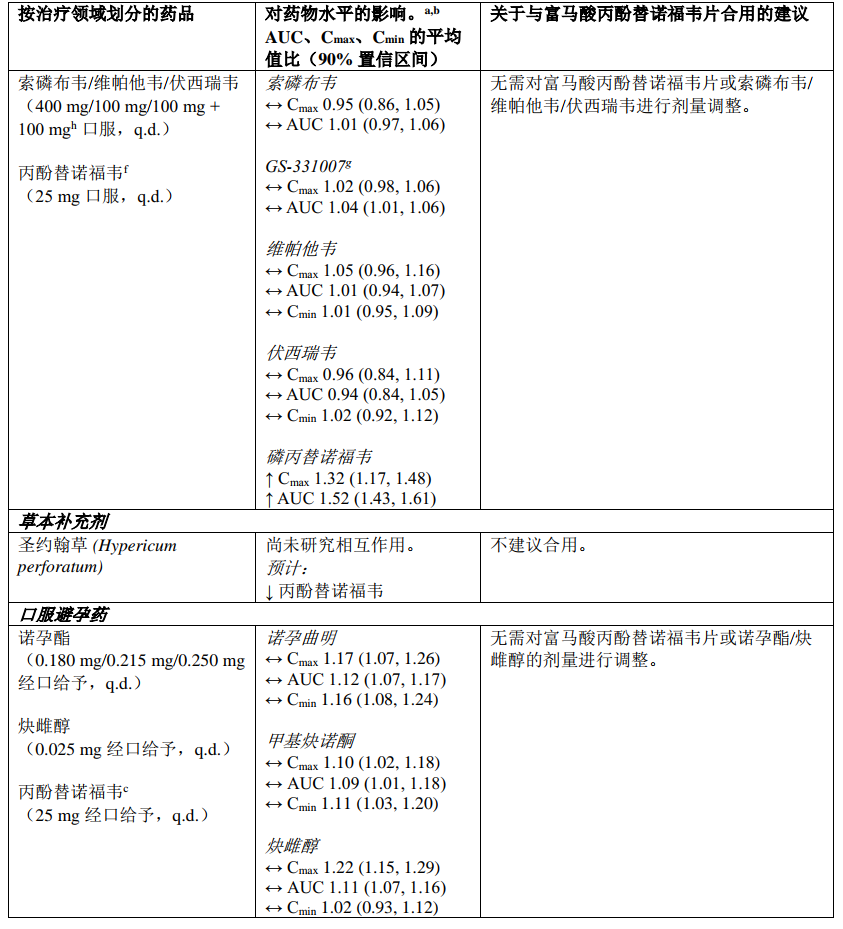
a. 所有相互作用研究均在健康志愿者中进行
b. 所有无作用界限范围为 70% ‑ 143%
c. 使用恩曲他滨/丙酚替诺福韦固定剂量复合片剂开展研究
d. 一种敏感性 CYP3A4 底物
e. 使用艾维雷韦/考比司他/恩曲他滨/丙酚替诺福韦固定剂量复合片剂开展研究
f. 使用恩曲他滨/利匹韦林/丙酚替诺福韦固定剂量复合片剂开展研究
g. 索磷布韦的主要循环核苷代谢产物
h. 额外使用伏西瑞韦100mg 开展研究,以达到HCV感染患者中的预期伏西瑞韦暴露量。
【药物过量】
如果发生药物过量,则必须监测患者是否有毒性迹象(参见【不良反应】)。
富马酸丙酚替诺福韦片药物过量的治疗需要采取一般支持性措施,包括监测生命体征以及观察患者的临床状态。
替诺福韦可通过血液透析有效清除,提取系数约为 54%。尚不清楚腹膜透析是否能够去除替诺福韦。
【临床试验】
富马酸丙酚替诺福韦片在慢性乙型肝炎患者中的疗效和安全性基于在海外和中国大陆进行的两项随机、双盲、活性对照研究 GS‑US‑320‑0108(“研究108”)和 GS‑US‑320‑0110(“研究110”)中的 48 周和96周数据而定。富马酸丙酚替诺福韦片安全性还得到来自研究108和110中从第 96 周至第 120 周继续接受盲态治疗的海外患者以及从第 96 周至第 120 周参与研究108和110开放标签期的海外患者的汇总数据支持(N = 361 名继续接受富马酸丙酚替诺福韦片;N = 180 名在第 96 周从富马酸替诺福韦酯转换至富马酸丙酚替诺福韦片)。
两项试验中的主要疗效终点均为第48周血浆 HBV DNA 水平低于 29 IU/mL 的患者比例。与海外研究中的富马酸替诺福韦酯相比,富马酸丙酚替诺福韦片在实现 HBV DNA 低于 29 IU/mL 方面符合非劣效性标准。
海外患者的临床数据
在研究108中,按 2:1 的比例对未接受过治疗和接受过治疗且存在肝功能代偿的 HBeAg 阴性海外患者进行随机分组,使其接受富马酸丙酚替诺福韦片 (25mg; N = 285) 每日一次或富马酸替诺福韦酯 (300mg; N = 140) 每日一次给药。这些患者的平均年龄为 46 岁,61% 为男性,72% 为亚裔,25% 为白人,2%(8 名受试者)为黑人;24%、38% 和 31%的患者分别为 HBV 基因型 B、C 和 D。21% 的患者接受过治疗(先前接受口服抗病毒药物治疗,包括恩替卡韦 (N = 41)、拉米夫定 (N = 42)、富马酸替诺福韦酯 (N= 21) 或其他 (N = 18))。基线时,血浆 HBV DNA 平均值为 5.8log10IU/mL,血清 ALT 平均值为 94 U/L,且 9% 的患者有肝硬化病史。
在研究110中,按 2:1 的比例对未接受过治疗和接受过治疗且存在肝功能代偿的 HBeAg 阳性海外患者进行随机分组,使其接受富马酸丙酚替诺福韦片 (25mg; N = 581) 每日一次或富马酸替诺福韦酯 (300mg; N = 292) 每日一次给药。这些患者的平均年龄为 38 岁,64% 为男性,82% 为亚裔,17% 为白人,<1%(5 名受试者)为黑人。17%、52% 和 23% 的患者分别为 HBV 基因型 B、C 和 D。26% 的患者接受过治疗(先前接受口服抗病毒药物治疗,包括阿德福韦 (N=42)、恩替卡韦 (N = 117)、拉米夫定 (N = 84)、替比夫定 (N=25)、富马酸替诺福韦酯 (N = 70) 或其他 (N = 17))。基线时,血浆 HBV DNA 平均值为 7.6log10IU/mL,血清 ALT 平均值为 120 U/L,且 7% 的患者有肝硬化病史。
研究108和研究110至 48 周时海外患者的治疗结局列于表3 和表4中。至第 96 周时海外患者的其他结局列于表5中。
表3:第48周时海外患者的HBV DNA疗效参数a
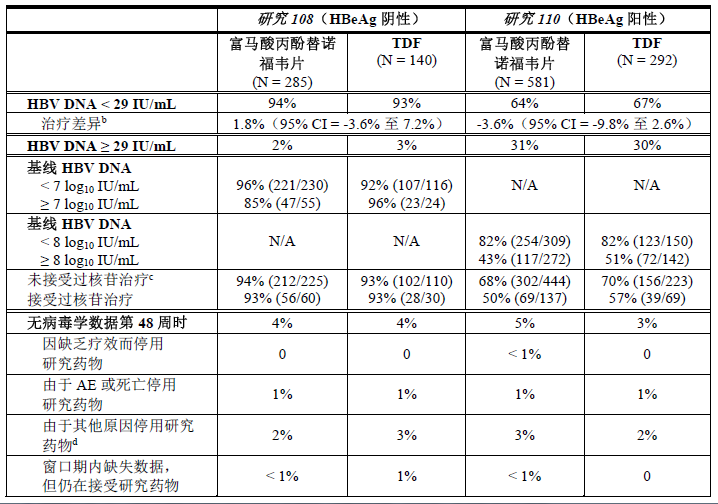
N/A = 不适用
TDF=富马酸替诺福韦酯
a. 缺失 = 失败分析。
b. 经基线血浆 HBV DNA 类别和口服抗病毒药物治疗状态分层调整。
c. 未接受过治疗的受试者接受了 < 12 周的任何核苷或核苷酸类似物(包括富马酸替诺福韦酯或丙酚替诺福韦)口服抗病毒治疗。
d. 包括由于除 AE、死亡或者缺乏或失去疗效以外的原因(如撤销同意、失访等)而停止治疗的患者。
表4:第48周时海外患者的其他疗效参数a
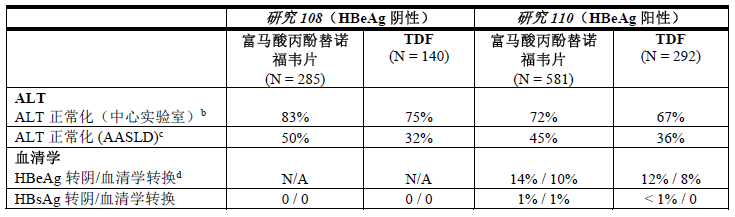
N/A = 不适用
TDF=富马酸替诺福韦酯
a. 缺失 = 失败分析。
b. 用于 ALT 正常化分析的人群仅包括基线时 ALT 超过中心实验室范围正常值上限 (ULN) 的患者。ALT 的中心实验室 ULN 如下:18 至<69岁和 ≥69的男性分别为 ≤43 U/L 和 ≤35 U/L;18 至 <69岁和 ≥69的女性分别为 ≤34U/L 和 ≤32U/L。
c. 用于 ALT 正常化分析的人群仅包括基线时 ALT 超过美国肝病研究协会 (AASLD) 标准 ULN(根据2016AASLD指导原则,对于男性和女性,分别为 >30 U/L 和 > 19 U/L) 的患者。
d. 用于血清学分析的人群仅包括基线时抗原(HBeAg)呈阳性且抗体(HBeAb)呈阴性或缺失的患者。
研究108和研究110中48周后的海外患者经验
在第 96周,继续丙酚替诺福韦治疗时保持了病毒抑制以及生物化学和血清学应答(参见表5)。
表5:第96周时海外患者的HBV DNA和其他疗效参数a
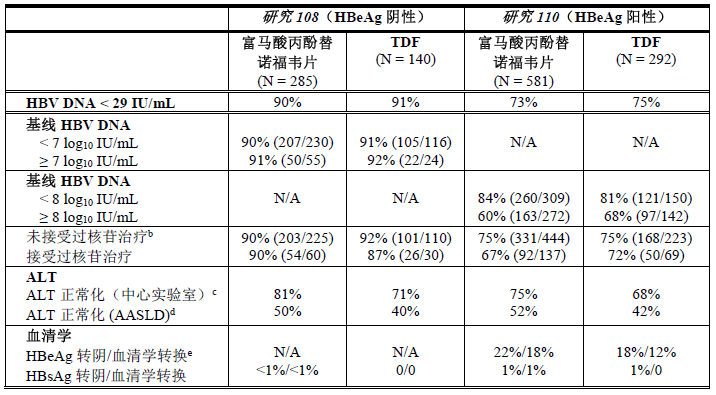
N/A = 不适用
TDF=富马酸替诺福韦酯
a. 缺失 = 失败分析
b. 未接受过治疗的受试者包括接受了 < 12 周的任何核苷或核苷酸类似物(包括富马酸替诺福韦酯或丙酚替诺福韦)口服抗病毒治疗。
c. 用于 ALT 正常化分析的人群仅包括基线时 ALT 超过中心实验室范围ULN的患者。ALT 的中心实验室 ULN 如下:18 至<69岁和 ≥69的男性分别为 ≤43 U/L 和 ≤35 U/L;18 至 <69岁和 ≥69的女性分别为 ≤34U/L 和 ≤32U/L。
d. 用于 ALT 正常化分析的人群仅包括基线时 ALT 超过 AASLD 标准 ULN(根据2016AASLD指导原则,男性为 > 30 U/L,女性为 > 19 U/L)的患者。
e. 用于血清学分析的人群仅包括基线时抗原 (HBeAg) 呈阳性且抗体 (HBeAb) 呈阴性或缺失的患者。
骨矿物质密度测量指标变化
在两项研究中,96 周治疗后,与富马酸替诺福韦酯相比,丙酚替诺福韦所致骨矿物质密度(BMD;根据髋部和腰椎双能 X 光吸收测量法 [DXA] 分析测定)百分比降幅平均值更小。
在第 96 周后继续接受盲态治疗的海外患者中,第 120 周时各组中的 BMD 平均百分比变化与第 96 周时相似。在这两项研究的开放标签期内,在继续接受富马酸丙酚替诺福韦片治疗的海外患者中从第 96 周至第 120 周的腰椎和全髋关节 BMD 平均百分比变化分别为 +0.6% 和 0%,相比之下,在第 96 周时从富马酸替诺福韦酯转换至富马酸丙酚替诺福韦片的患者中,腰椎和全髋关节相应值分别为 +1.7% 和 +0.6%。
肾功能测量指标变化
在两项研究中,96周治疗后,与富马酸替诺福韦酯相比,丙酚替诺福韦所致肾安全性参数变化更小(通过使用 Cockcroft-Gault 法得出的 CrCl 估计值降幅中位值更小以及尿视黄醇结合蛋白与肌酐之比和尿β-2微球蛋白与肌酐之比百分比增幅中位值更小)(参见【注意事项】)。
在研究108和110中第 96 周后继续接受盲态治疗的海外患者中,第 120 周时各组中的肾实验室检测参数相对于基线的变化与第 96 周时相似。在研究108和110的开放标签期内,在继续接受富马酸丙酚替诺福韦片治疗的患者中从第 96 周至第 120 周的血清肌酐变化平均值 (±SD) 为 -0.002 (0.10) mg/dL,相比之下,在第 96 周时从富马酸替诺福韦酯转换至富马酸丙酚替诺福韦片的患者中,相应值为 ‑0.008 (0.09) mg/dL。在开放标签期内,在继续接受富马酸丙酚替诺福韦片治疗的海外患者中从第 96 周至第 120 周的 eGFR 中位变化为 -0.6 mL/min,相比之下,在第 96 周时从富马酸替诺福韦酯转换至富马酸丙酚替诺福韦片的患者中,相应值为 +1.8 mL/min。
中国大陆患者的临床数据
在研究108的中国大陆队列中,按 2:1 的比例对初治和经治且存在肝功能代偿的 HBeAg 阴性中国大陆患者进行随机分组,使其接受富马酸丙酚替诺福韦片 (25mg) 每日一次或富马酸替诺福韦酯 (300mg) 每日一次给药。104 名受试者接受富马酸丙酚替诺福韦片给药,50 名受试者接受富马酸替诺福韦酯给药。平均年龄为 43 岁,73% 为男性;45%、1%、51% 和 1% 的患者分别为 HBV 基因型 B、B/C、C 和 D。
在研究110的中国大陆队列中,按 2:1 的比例对初治和经治且存在肝功能代偿的 HBeAg 阳性中国大陆患者进行随机分组,使其接受富马酸丙酚替诺福韦片 (25mg) 每日一次或富马酸替诺福韦酯 (300mg) 每日一次给药。123 名受试者接受富马酸丙酚替诺福韦片给药,57 名受试者接受富马酸替诺福韦酯给药。平均年龄为 34 岁,73% 为男性;29% 和 70% 的患者分别为 HBV 基因型 B 和 C。
研究108和研究110至 48 周及96周时中国大陆患者的治疗结局列于表6和表7中。
表6:第48周和第96周时中国大陆患者的HBV DNA疗效参数a
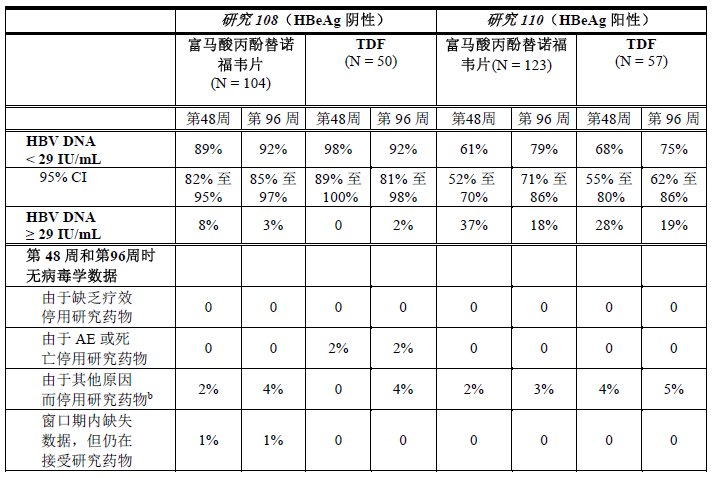
N/A = 不适用
TDF=富马酸替诺福韦酯
a. 缺失 = 失败分析。
b. 包括由于除 AE、死亡或者缺乏或失去疗效以外的原因(如撤销同意、失访等)而停止治疗的患者。
表7:第48周和第96周时中国大陆患者的其他疗效参数a
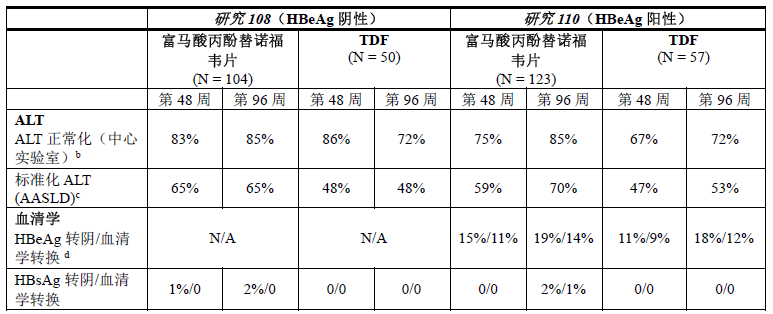
N/A = 不适用
TDF=富马酸替诺福韦酯
a. 缺失 = 失败分析。
b. 用于 ALT 正常化分析的人群仅包括基线时 ALT 超过中心实验室范围正常值上限 (ULN) 的患者。ALT 的中心实验室 ULN 如下:18 至<69岁和 ≥69的男性分别为 ≤43 U/L 和 ≤35 U/L;18 至 <69岁和 ≥69的女性分别为 ≤34U/L 和 ≤32U/L。
c. 用于 ALT 正常化分析的人群仅包括基线时 ALT 超过美国肝病研究协会 (AASLD) 标准 ULN 的患者。AASLD ALT ULN 标准如下:根据2016 AASLD 指导原则,基线时男性和女性分别为 > 30 U/L 和 > 19 U/L。
d. 用于血清学分析的人群仅包括基线时抗原呈阳性 (HBeAg) 且抗体呈阴性 (HBeAb) 或缺失的患者。
中国大陆患者的骨矿物质密度测定指标变化
根据这两项研究的汇总数据,经过96 周治疗后,丙酚替诺福韦与中国大陆患者脊柱 BMD 相对于基线的小幅平均百分比增加及髋部 BMD 相对于基线的小幅平均百分比降低有关,相比之下,富马酸替诺福韦酯组中脊柱 BMD 与基线相比平均百分比降低且髋部 BMD 的平均百分比降幅更大。
中国大陆患者的肾功能测定指标变化
基于两项研究中的汇总数据,96周治疗后,与富马酸替诺福韦酯相比,丙酚替诺福韦所致中国大陆患者肾安全性参数变化较小(丙酚替诺福韦组与富马酸替诺福韦组相比,血清肌酐的平均增加较小,丙酚替诺福韦组的eGFR中位值降低较富马酸替诺福韦组小,与富马酸替诺福韦酯组相比尿视黄醇结合蛋白与肌酐之比的百分比增幅中位值较小;丙酚替诺福韦组尿 β‑2‑微球蛋白与肌酐之比的百分比中位值有所降低,与之相比,富马酸替诺福韦酯组的百分比中位值有所升高)(参见【注意事项】)。
【药理毒理】
1、药理作用
1)作用机制
丙酚替诺福韦是替诺福韦的一种亚磷酰胺药物前体(2'-脱氧腺苷一磷酸类似物)。
丙酚替诺福韦通过被动扩散以及肝脏摄取性转运体 OATP1B1 和 OATP1B3 进入原代肝细胞。在原代肝细胞内丙酚替诺福韦主要通过羧酸酯酶1进行水解以形成替诺福韦。细胞内替诺福韦随后经过磷酸化,形成药理学活性代谢产物二磷酸替诺福韦。二磷酸替诺福韦借助 HBV 逆转录酶整合嵌入病毒 DNA(这会导致 DNA 链终止),从而抑制 HBV 复制。
替诺福韦对乙型肝炎病毒和人类免疫缺陷病毒(HIV‑1 和 HIV‑2)有特异性活性。基于包括线粒体 DNA 分析在内的多项试验,二磷酸替诺福韦是哺乳动物 DNA 聚合酶(包括线粒体 DNA 聚合酶 γ)的一种弱抑制剂,且在体外无线粒体毒性迹象。
2)抗病毒活性
在 HepG2 细胞中评估了丙酚替诺福韦对一组代表基因型 A-H 的 HBV 临床分离株的抗病毒活性。丙酚替诺福韦的 EC50(50% 有效浓度)值范围为 34.7 至 134.4 nM,EC50总体平均值为 86.6 nM。HepG2 细胞中的 CC50(50% 细胞毒性浓度)> 44400 nM。
3)耐药性
在对接受富马酸丙酚替诺福韦片治疗的海外患者进行的汇总分析中,针对出现病毒学突破(HBV DNA < 69 IU/mL 之后连续 2 次随访的 HBV DNA ≥ 69 IU/mL,或相对于最低值 HBVDNA 增加 1.0 log10或以上)的患者、HBV DNA ≥ 69IU/mL 的患者(仅第96周)或在第24周或之后提前停药时HBV DNA ≥ 69IU/mL 的患者,执行了配对基线和治疗期 HBV 分离株的序列分析。在第48周(N=20)和第96周(N=72)的海外患者分析中,未在这些分离株中鉴别出与富马酸丙酚替诺福韦片耐药性相关的氨基酸取代(基因型和表型分析)。
2)交叉耐药性
在 HepG2 细胞中评估了丙酚替诺福韦对一组含核苷(酸)逆转录酶抑制剂突变的分离株的抗病毒活性。表达与拉米夫定耐药性相关的 rtV173L、rtL180M 和 rtM204V/I 取代的 HBV 分离株仍对丙酚替诺福韦敏感(EC50变化倍数 < 2)。表达与恩替卡韦耐药性相关的 rtL180M、rtM204V + rtT184G、rtS202G 或 rtM250V 取代的 HBV 分离株仍对丙酚替诺福韦敏感。表达与阿德福韦耐药性相关的 rtA181T、rtA181V 或 rtN236T 单突变的 HBV 分离株仍对丙酚替诺福韦敏感;但是,表达 rtA181V + rtN236T 的 HBV 分离株显示对丙酚替诺福韦的敏感性降低(EC50变化倍数为 3.7)。尚不清楚这些取代的临床相关性。
2、非临床毒理学
在大鼠和犬中进行的非临床研究显示骨骼和肾脏是主要的毒性靶器官。在替诺福韦暴露量至少是丙酚替诺福韦给药后预计暴露量的四倍时,在大鼠和犬中观察到 BMD 降低这一骨骼毒性。在丙酚替诺福韦和替诺福韦暴露量分别约是丙酚替诺福韦给药后预计暴露量的 4 和 17 倍时,在犬眼部出现了极轻微的组织细胞浸润。
在常规遗传毒性分析中丙酚替诺福韦无致突变性或致染色体断裂性。
与富马酸替诺福韦酯相比,丙酚替诺福韦给药后,大鼠和小鼠中的替诺福韦暴露量较低,所以仅使用富马酸替诺福韦酯进行了致癌性研究和大鼠围产期-产后研究。使用替诺福韦酯(富马酸盐形式)进行的致癌可能性常规研究与使用替诺福韦酯(富马酸盐形式)或丙酚替诺福韦进行的生殖和发育常规研究显示对人类无特殊危害。在大鼠和兔中进行的生殖毒性研究显示对交配、生育力、妊娠或胎仔参数无影响。但是,在母体毒性剂量下的围产期-产后毒性研究中,富马酸替诺福韦酯降低了幼仔的活力指数和体重。对小鼠进行的长期经口给药致癌性研究显示,十二指肠肿瘤发病率较低,认为这可能与在 600 mg/kg/天的高剂量下胃肠道药物局部浓度较高相关。尚未确定小鼠肿瘤形成的机制及对于人类的潜在相关性。
【药代动力学】
药物治疗组:全身用抗病毒药物,核苷和核苷酸逆转录酶抑制剂;ATC 代码:J05AF13。
1、吸收
向空腹状态下的慢性乙型肝炎成年患者经口给予富马酸丙酚替诺福韦片后,约在给药后 0.48 小时观察到丙酚替诺福韦血浆浓度峰值。基于 3 期海外 CHB 受试者群体药代动力学分析,丙酚替诺福韦 (N=698) 和替诺福韦 (N=856) 的平均稳态 AUC0-24分别为0.22µg·hr/mL 和 0.32µg·hr/mL。丙酚替诺福韦和替诺福韦的稳态 Cmax分别为 0.18 和 0.02µg/mL。相对于空腹条件,随高脂肪餐给予单剂量富马酸丙酚替诺福韦片使丙酚替诺福韦暴露量增加 65%。
基于 3 期中国大陆 CHB 受试者群体药代动力学分析,丙酚替诺福韦 (N=180) 和替诺福韦 (N=225) 的平均稳态 AUC0-24分别为 0.17µg·hr/mL 和 0.26µg·hr/mL。丙酚替诺福韦和替诺福韦的稳态 Cmax分别为 0.18 和 0.02µg/mL。
2、分布
临床试验期间采集的样品中,丙酚替诺福韦与人血浆蛋白的结合率约为 80%。替诺福韦与人血浆蛋白的结合率低于 0.7%,且在 0.01-25 μg/mL 的范围内与浓度无关。
3、生物转化
代谢是人体内丙酚替诺福韦的主要消除途径,占口服剂量的比例 >80%。体外研究已表明,丙酚替诺福韦通过肝细胞内的羧酸酯酶-1 以及 PBMC 和巨噬细胞内的组织蛋白酶 A 代谢为替诺福韦(主要代谢产物)。在体内,丙酚替诺福韦在细胞内水解形成替诺福韦(主要代谢产物),后者经磷酸化后形成活性代谢产物二磷酸替诺福韦。
在体外,丙酚替诺福韦不会由 CYP1A2、CYP2C8、CYP2C9、CYP2C19 或 CYP2D6 代谢。极少量的丙酚替诺福韦被 CYP3A4 代谢。
4、消除
完整丙酚替诺福韦的肾排泄是次要途径,在尿中消除的剂量<1%。丙酚替诺福韦主要在代谢为替诺福韦后被消除。丙酚替诺福韦和替诺福韦的中位血浆半衰期分别为 0.51 和 32.37 小时。替诺福韦由肾脏通过肾小球滤过和肾小管主动分泌的方式从体内消除。
线性/非线性
在 8 至 125 mg 剂量范围内,丙酚替诺福韦暴露量与剂量成比例。
5、特殊人群中的药代动力学
1)年龄、性别和族群
已确定根据年龄或族群列出的药代动力学未出现临床相关差异。未将根据性别列出的药代动力学差异视为具有临床相关性。
2)肝功能损害
在重度肝功能损害患者中,丙酚替诺福韦和替诺福韦总血浆浓度低于在肝功能正常受试者中观察到的相应值。经蛋白结合率调整后,重度肝功能损害患者与肝功能正常患者中的未结合(游离)丙酚替诺福韦血浆浓度相似。
3)肾功能损害
在丙酚替诺福韦研究中,在健康受试者与重度肾功能损害患者(CrCl 估计值 >15 但<30mL/min)之间未观察到丙酚替诺福韦或替诺福韦药代动力学的临床相关差异。
4)儿童人群
在接受丙酚替诺福韦 (10mg) 给药(接受艾维雷韦、考比司他和恩曲他滨固定剂量复合片剂 (E/C/F/TAF; Genvoya))的未接受过治疗的 HIV‑1 感染青少年中,评估了丙酚替诺福韦和替诺福韦的药代动力学。在 HIV‑1 感染青少年与成人受试者之间未观察到丙酚替诺福韦或替诺福韦的药代动力学存在临床相关差异。
【贮藏】
30°C 以下保存。
【有效期】
24 个月
【包装】
每瓶 30 片。
高密度聚乙烯 (HDPE) 瓶,使用带感应活性铝箔内衬的聚丙烯连续螺纹防儿童开启瓶盖密封。每瓶均含硅胶干燥剂和聚酯棉塞。
提供以下包装规格:每盒内含有 1 瓶,每瓶含 30 片薄膜衣片。
【注册证号】
H20180060
【执行标准】
JX20180150
信息来源:百度百科