阿昔替尼(英利达)的作用机制、药效学、药代动力学研究,解释了药物在体内的分解和吸收,已经安全性和有效性。
(1)作用机制
阿昔替尼(英利达)已显示在治疗血浆浓度下抑制受体酪氨酸激酶,包括血管内皮生长因子受体 (VEGFR)-1、VEGFR-2 和 VEGFR-3。这些受体与病理性血管生成、肿瘤生长和癌症进展有关。在体外和小鼠模型中,阿昔替尼(英利达)抑制 VEGF 介导的内皮细胞增殖和存活。在肿瘤异种移植小鼠模型中,阿昔替尼(英利达)被证明可抑制肿瘤生长和 VEGFR-2 的磷酸化。
(2)药效学
在一项随机化,单盲,双向交叉研究在 35 例健康受试者中评价单次口服剂量阿昔替尼(英利达)(5 mg)在不存在和存在 400 mg 酮康唑时对 QTc 间期的影响。直至给药后 3 小时,未检测到安慰剂的平均 QTc 间期(即 >20 毫秒)有大的变化。
(3)药代动力学
群体药代动力学分析汇集了来自健康受试者和癌症患者的 17 项试验的数据。具有一级吸收和滞后时间的二室配置模型充分描述了阿昔替尼(英利达)的浓度-时间曲线。
吸收和分布
单次口服 5-mg 剂量给药后,中位 Tmax 范围为 2.5 至 4.1 小时。根据血浆半衰期,预计在给药后 2 至 3 天内达到稳态。与单剂量给药相比,每天两次给予 5 mg阿昔替尼(英利达)导致蓄积约 1.4 倍。在稳定状态下,阿昔替尼(英利达)在 1 mg 至 20 mg 剂量范围内表现出近似线性的药代动力学。口服 5 mg 剂量后,阿昔替尼(英利达)的平均绝对生物利用度为 58%。
与隔夜空腹比较,阿昔替尼(英利达)与中等脂肪膳食给药导致 AUC 低 10%和高脂肪,高热量膳食导致 AUC 高 19%。阿昔替尼(英利达)可以有或没有食物同服.
阿昔替尼(英利达)与人血浆蛋白高度结合(>99%),优先结合白蛋白和适度结合 α1-酸性糖蛋白。在晚期肾癌患者 (n=20) 中,在进食状态下每天两次服用 5 mg,几何平均数 (CV%) Cmax和 AUC 0–24分别为 27.8 (79%) ng/mL 和 265 (77 %)分别为 ng.h/mL。几何平均数 (CV%) 清除率和表观分布容积分别为 38 (80%) L/h 和 160 (105%) L。
代谢和消除
阿昔替尼(英利达)的血浆半衰期范围从 2.5 至 6.1 小时。阿昔替尼(英利达)要在肝脏中被 CYP3A4/5 代谢,较小程度上被 CYP1A2,CYP2C19,和 UGT1A1 代谢。口服给予 5-mg 放射性剂量的阿昔替尼(英利达)后,约 41% 的放射性在粪便中排出,约 23% 在尿液中回收。未改变的阿昔替尼(英利达)占剂量的 12%,是粪便中确定的主要成分。未在尿液中检测到未改变的阿昔替尼(英利达);羧酸和亚砜代谢物占尿液中放射性的大部分。在血浆中,N-葡萄糖醛酸代谢物代表主要的放射性成分(循环放射性的 50%)和未变化的阿昔替尼(英利达)和亚砜代谢物各占循环放射性的约 20%。
与阿昔替尼(英利达)相比,亚砜和 N-葡萄糖醛酸代谢物显示出对 VEGFR-2 的体外效力低约 400 倍。
药物相互作用
其他药物对阿昔替尼(英利达)的影响
阿昔替尼(英利达)主要在肝脏中被 CYP3A4/5 代谢。此外,阿昔替尼(英利达)的水溶性取决于 pH,pH 值越高,溶解度越低。强 CYP3A4/5 抑制剂、强 CYP3A4/5 诱导剂和抗酸剂对阿昔替尼(英利达)药代动力学的影响见下图。
联合用药和肝损伤对阿昔替尼(英利达)药代动力学的影响
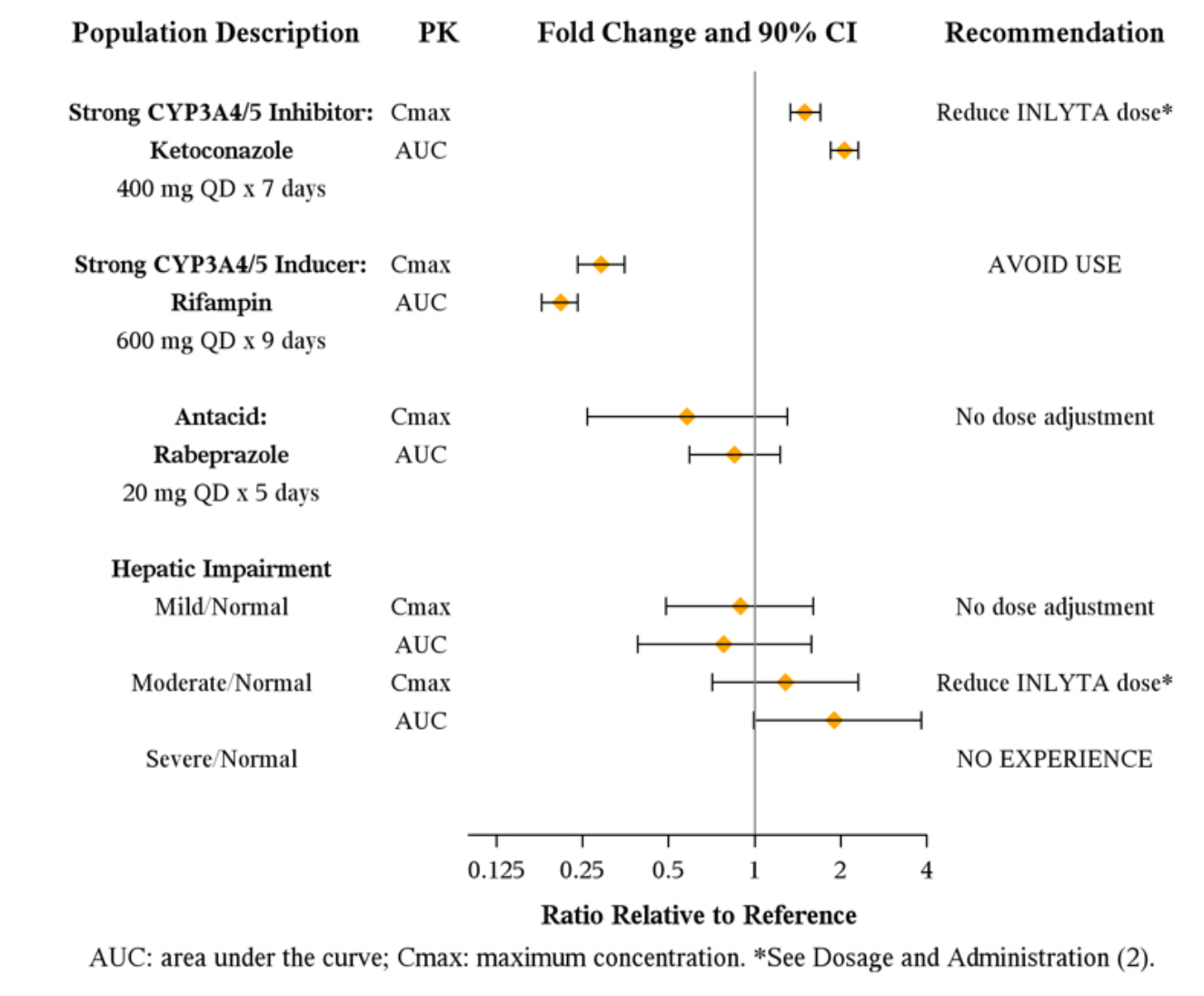
总结: 阿昔替尼(英利达)的药物相互作用研究指明了哪些药物会对阿昔替尼(英利达)的作用机制有影响。患者在接受治疗期间要避免强 CYP3A4/5 抑制剂类药物。